题目内容
14.设NA为可伏加德罗常数的值,则下列说法正确的是( )| A. | 标准状况下,4.48LCH3Cl中含有的原子数为NA | |
| B. | 常温常压下,14 g N2含有的核外电子数为5NA | |
| C. | 10L PH=1的硫酸中含有的氢离子数为2 NA | |
| D. | 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数为2NA |
分析 A、求出一氯甲烷的物质的量,然后根据1mol一氯甲烷中含5mol原子来分析;
B、求出氮气的物质的量,然后根据1mol氮气中含14mol电子来分析;
C、pH=1的硫酸溶液中氢离子浓度为0.1mol/L;
D、氢氧燃料电池中,正极上放电的是氧气.
解答 解:A、标况下4.48L一氯甲烷的物质的量为0.2mol,而1mol一氯甲烷中含5mol原子,故0.2mol中含1mol原子即NA个,故A正确;
B、14g氮气的物质的量为n=$\frac{14g}{28g/mol}$=0.5mol,而1mol氮气中含14mol电子,故0.5mol氮气中含7mol电子即7NA个,故B错误;
C、pH=1的硫酸溶液中氢离子浓度为0.1mol/L,故10L溶液中氢原子的物质的量为1mol,个数为NA个,故C错误;
D、氢氧燃料电池中,正极上放电的是氧气,故当正极上有22.4L氧气即1mol氧气放电时,电路中转移4mol电子即4NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.某校化学兴趣小组在学习了过氧化钠性质后,进一步研究其与SO2反应情况,查阅相关资料知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成.有同学认为:CO2、SO2虽然都是酸性氧化物,但SO2具有较强的还原性,CO2无还原性,反应原理应该不相同,并设计如下实验进行探究.
(1)[提出假设]向一定量的过氧化钠固体中通入足量的SO2,对反应后的固体产物成分及反应原理提出如下假设:
假设一:反应后固体中只有Na2SO3,证明SO2未被氧化;
假设二:反应后固体中只有Na2SO4,证明SO2完全被氧化;
假设三:反应后固体中固体为Na2SO3和Na2SO4的混合物,证明二氧化硫部分被氧化.
(2)[定性研究]
为验证假设三是否成立,兴趣小组进行如下研究,请你完成下表中内容
(3)[定量研究]通过测量气体的体积判断发生的化学反应,实验装置如下:
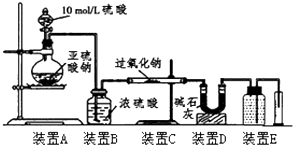
①装置D的作用是吸收未反应的SO2.
②实验测得装置C中过氧化钠质量增加了m1g,装置D质量增加了m2g,装置E中收集到的气体为VL(已换算成标准状况下),用上述有关测量数据进行判断
(1)[提出假设]向一定量的过氧化钠固体中通入足量的SO2,对反应后的固体产物成分及反应原理提出如下假设:
假设一:反应后固体中只有Na2SO3,证明SO2未被氧化;
假设二:反应后固体中只有Na2SO4,证明SO2完全被氧化;
假设三:反应后固体中固体为Na2SO3和Na2SO4的混合物,证明二氧化硫部分被氧化.
(2)[定性研究]
为验证假设三是否成立,兴趣小组进行如下研究,请你完成下表中内容
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取反应后的固体放入试管中,… |

①装置D的作用是吸收未反应的SO2.
②实验测得装置C中过氧化钠质量增加了m1g,装置D质量增加了m2g,装置E中收集到的气体为VL(已换算成标准状况下),用上述有关测量数据进行判断
| SO2被氧化的程度 | V与m1或m2的关系 |
| 完全被氧化 | V=0 |
| 部分被氧化 | 0<V<$\frac{7{m}_{1}}{30}$或m1>$\frac{30V}{7}$ |
| 未被氧化 | V=$\frac{7{m}_{1}}{30}$或m1=$\frac{30V}{7}$ |
5.进行化学实验、观测实验现象,通过分析、推理得出正确的结论是化学学习的方法之一.下列对有关实验事实的解释正确的是( )
| A. | SO2气体使高锰酸钾溶液褪色,体现了SO2的漂白性 | |
| B. | 在AgNO3的溶液中加入锌粉,能置换出银,说明AgNO3的还原性比Zn(NO3)2强 | |
| C. | 浓硝酸在光照条件下变黄,说明浓硝酸易分解生成有色产物且溶于浓硝酸 | |
| D. | 浓硫酸放入蔗糖中,能使蔗糖碳化,说明浓硫酸具有强氧化性 |
2.社会实践活动中,课外兴趣小组对某钢铁厂的铁矿石样品和钢样进行实验、分析、计算,了解了该钢铁厂生产原料、产品的相关信息.下面请你根据他们的实验帮助计算回答:
取该厂的某钢样粉末28.36g(假设只含Fe和C),在氧气流中充分反应,将产生的气体通入足量的澄清石灰水中,得到3g白色沉淀.
(1)计算此钢样粉末中铁和碳的质量之比.
(2)再取三份不同质量的钢样粉末分别加到50 g质量分数相同的硫酸中,充分反应后,测得的实验数据如下表所示:(标准状况下,2g H2的体积为22.4 L)
请根据表中数据计算硫酸中H2SO4的质量分数.
(3)若在实验Ⅱ中继续加入m g钢样粉末,计算反应结束后剩余的固体质量为多少?(用含m的代数式表示)
取该厂的某钢样粉末28.36g(假设只含Fe和C),在氧气流中充分反应,将产生的气体通入足量的澄清石灰水中,得到3g白色沉淀.
(1)计算此钢样粉末中铁和碳的质量之比.
(2)再取三份不同质量的钢样粉末分别加到50 g质量分数相同的硫酸中,充分反应后,测得的实验数据如下表所示:(标准状况下,2g H2的体积为22.4 L)
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入钢样粉末的质量/g | 2.836 | 5.672 | 8.508 |
| 生成气体的体积(标准状况)/L | 1.12 | 2.24 | 2.80 |
(3)若在实验Ⅱ中继续加入m g钢样粉末,计算反应结束后剩余的固体质量为多少?(用含m的代数式表示)
19.2010年10月16日,一场大雾袭击了京珠高速,导致京珠高速东西湖段接连发生数十起连环车祸.其中雾属于下列分散系中的( )
| A. | 溶液 | B. | 悬浊液 | C. | 乳浊液 | D. | 胶体 |
6.下列分子中,属于极性分子的是( )
| A. | N2 | B. | O2 | C. | NH3 | D. | CO2 |
3. 下图曲线a表示反应X(g)+Y(g)+N(s)?Z(g)+M(g)△H<0进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
下图曲线a表示反应X(g)+Y(g)+N(s)?Z(g)+M(g)△H<0进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
 下图曲线a表示反应X(g)+Y(g)+N(s)?Z(g)+M(g)△H<0进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
下图曲线a表示反应X(g)+Y(g)+N(s)?Z(g)+M(g)△H<0进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 升高温度 | B. | 加大N的投入量 | C. | 添加催化剂 | D. | 加大X的投入量 |
4.有a%、b%的氨水溶液和硫酸溶液,按下图所示混合,得到甲、乙、丙、丁四种溶液:四种溶液的密度由大到小的顺序为( )

| A. | 甲、乙、丙、丁 | B. | 丙、丁、乙、甲 | C. | 丙、丁、甲、乙 | D. | 丁、丙、乙、甲 |