题目内容
25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A、pH=1的溶液中:Na+、NH4+、NO3-、ClO- | ||
B、
| ||
| C、0.1 mol?L-1NaAlO2溶液中:Na+、Al3+、HCO3-、SO42- | ||
| D、常温下,在c(H+)水?c(OH-)水=10-26的溶液中:K+、Fe2+、Cl-、NO3- |
考点:离子共存问题
专题:
分析:A.pH=1的溶液中存在大量氢离子,次氯酸根离子与氢离子反应;
B.该溶液为碱性溶液,溶液中存在大量氢氧根离子,四种离子之间不发生反应,都不与氢氧根离子反应;
C.偏铝酸根离子、铝离子之间发生双水解反应,偏铝酸钠能够与碳酸氢根离子反应生成氢氧化铝沉淀和碳酸根离子;
D.该溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,硝酸根离子在酸性条件下具有强氧化性,能够氧化亚铁离子;亚铁离子能够与氢氧根离子反应.
B.该溶液为碱性溶液,溶液中存在大量氢氧根离子,四种离子之间不发生反应,都不与氢氧根离子反应;
C.偏铝酸根离子、铝离子之间发生双水解反应,偏铝酸钠能够与碳酸氢根离子反应生成氢氧化铝沉淀和碳酸根离子;
D.该溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,硝酸根离子在酸性条件下具有强氧化性,能够氧化亚铁离子;亚铁离子能够与氢氧根离子反应.
解答:
解:A.pH=1的溶液为酸性溶液,溶液中存在大量氢离子,ClO-离子与氢离子反应生成次氯酸,在溶液中不能大量共存,故A错误;
B.该溶液氢氧根离子浓度为0.01mol/L,K+、Ba2+、NO3-、Cl-离子之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故B正确;
C.AlO2-、HCO3-之间反应生成氢氧化铝沉淀和碳酸根离子,Al3+、AlO2-之间发生双水解反应,在溶液中不能大量共存,故C错误;
D.常温下,在c(H+)水?c(OH-)水=10-26的溶液中存在大量氢离子或氢氧根离子,Fe2+与氢氧根离子反应,NO3-在酸性溶液中能够氧化Fe2+,在溶液中不能大量共存,故D错误;
故选B.
B.该溶液氢氧根离子浓度为0.01mol/L,K+、Ba2+、NO3-、Cl-离子之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故B正确;
C.AlO2-、HCO3-之间反应生成氢氧化铝沉淀和碳酸根离子,Al3+、AlO2-之间发生双水解反应,在溶液中不能大量共存,故C错误;
D.常温下,在c(H+)水?c(OH-)水=10-26的溶液中存在大量氢离子或氢氧根离子,Fe2+与氢氧根离子反应,NO3-在酸性溶液中能够氧化Fe2+,在溶液中不能大量共存,故D错误;
故选B.
点评:本题考查离子共存的判断,题目难度中等,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的H+或OH-;是“可能”共存,还是“一定”共存等.

练习册系列答案
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案
相关题目
我国科学家制得了SiO2超分子纳米管,微观结构如图.下列叙述正确的是( )


| A、SiO2与干冰的晶体结构相似 |
| B、SiO2耐腐蚀,不与任何酸反应 |
| C、工业上用SiO2制备粗硅 |
| D、光纤主要成分是SiO2,具有导电性 |
下列关于卤素单质的叙述,正确的是( )
| A、单质的颜色随核电荷数的增加逐渐变浅 |
| B、随核电荷数的增加单质的氧化性逐渐减弱 |
| C、随核电荷数的增加气态氢化物的稳定性逐渐增强 |
| D、单质的熔沸点随核电荷数的增加逐渐降低 |
下列有关实验装置进行的相应实验,不能达到实验目的是( )
A、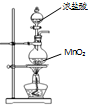 用装置制取氯气 |
B、 用装置除去氯气中的少量氯化氢和水蒸气 |
C、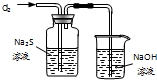 用装置可证明Cl2的氧化性强于S |
D、 用装置可以完成“喷泉”实验 |
相同物质的量的下列有机物,充分燃烧,消耗氧气量相同的是( )
| A、C3H4和C2H6 |
| B、C3H6和C4H8O |
| C、C3H6O2和C3H8O |
| D、C3H8O和C4H6O2 |


 ,请写出其涉及的反应(注明反应的条件
,请写出其涉及的反应(注明反应的条件