题目内容
下列实验能达到预期目的是( )
| 编号 | 实验内容 | 实验目的 |
| A | 室温下,用pH试纸分别测定浓度为0.1mol/L NaClO溶液和0.1mol/L CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 向10mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的 Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| D | 配制FeCl2溶液时,先将FeCl2溶于适量稀盐再用蒸馏水稀释,最后在试剂瓶中加入少量铜粉 | 抑制Fe2+水解,并防止Fe2+被氧化 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价,盐类水解的原理,难溶电解质的溶解平衡及沉淀转化的本质,比较弱酸的相对强弱的实验
专题:实验评价题,盐类的水解专题
分析:A.NaClO溶液具有强氧化性,不能利用pH试纸测定pH;
B.含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅,碳酸根离子水解平衡逆向移动,OH-浓度减小;
C.NaOH过量,发生沉淀的生成,而不是沉淀的转化;
D.加入少量铜粉,Cu与铁离子反应生成氯化亚铜,引入新杂质.
B.含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅,碳酸根离子水解平衡逆向移动,OH-浓度减小;
C.NaOH过量,发生沉淀的生成,而不是沉淀的转化;
D.加入少量铜粉,Cu与铁离子反应生成氯化亚铜,引入新杂质.
解答:
解:A.NaClO溶液具有强氧化性,不能利用pH试纸测定pH,应利用pH计测定pH比较酸性强弱,故A错误;
B.含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅,碳酸根离子水解平衡逆向移动,OH-浓度减小,则证明Na2CO3溶液中存在水解平衡,故B正确;
C.NaOH过量,发生沉淀的生成,而不是沉淀的转化,则不能比较相同温度下的Ksp[Mg(OH)2]、Ksp[Fe(OH)3],故C错误;
D.加入少量铜粉,Cu与铁离子反应生成氯化亚铜,引入新杂质,应加铁粉,防止Fe2+被氧化,故D错误;
故选B.
B.含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅,碳酸根离子水解平衡逆向移动,OH-浓度减小,则证明Na2CO3溶液中存在水解平衡,故B正确;
C.NaOH过量,发生沉淀的生成,而不是沉淀的转化,则不能比较相同温度下的Ksp[Mg(OH)2]、Ksp[Fe(OH)3],故C错误;
D.加入少量铜粉,Cu与铁离子反应生成氯化亚铜,引入新杂质,应加铁粉,防止Fe2+被氧化,故D错误;
故选B.
点评:本题考查化学实验方案的评价,为高频考点,涉及pH测定与酸性比较、盐类水解、沉淀生成和转化、溶液配制及氧化还原反应等,把握物质的性质及反应原理为解答的关键,侧重化学反应原理中高频考点的考查,注意操作的可行性、评价性分析,题目难度不大.

练习册系列答案
相关题目
 利用人工光合作用合成甲酸的原理为2CO2+2H2O
利用人工光合作用合成甲酸的原理为2CO2+2H2O| 太阳能 |
| 光触媒 |
| A、该装置将太阳能转化为化学能和电能 |
| B、电极1周围pH增大 |
| C、电极2上发生的反应为:CO2+2H++2e-═HCOOH |
| D、H+由电极1室经过质子膜流向电极2室 |
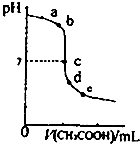 25℃时,向20.00mL NaOH溶液中逐滴加入0.20mo1?L-1的CH3COOH溶液得到如图曲线.下列说法正确的是( )
25℃时,向20.00mL NaOH溶液中逐滴加入0.20mo1?L-1的CH3COOH溶液得到如图曲线.下列说法正确的是( )| A、水电离出的氢离子浓度:a>b |
| B、c点时恰好中和 |
| C、在d~e之间存在如下关系C(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、e点时溶液中溶质是CH3COONa和CH3COOH |
在塑料原料加工时,添加塑化剂(DCHP)可以使其变得较为柔软,易于加工.塑化剂易溶于有机溶剂,是一种对人体有害的一类物质.塑化剂的一种制备方法如下:
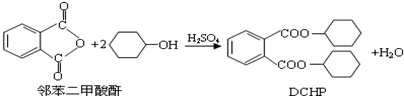
下列说法正确的是( )

下列说法正确的是( )
| A、DCHP的分子式为C20H28O4 |
| B、上述制备DCHP的反应属于取代反应 |
| C、DCHP苯环上的一氯代物有4种 |
| D、1mol DCHP最多可与含4mol NaOH的溶液反应 |
下列说法正确的是( )
| A、苯酚显酸性,是因为羟基对苯环影响的结果 |
| B、分子式为C2H4和C3H6的物质一定互为同系物 |
C、聚合物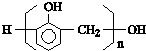 是苯酚和甲醛在一定条件下反应得到的高分子化合物 是苯酚和甲醛在一定条件下反应得到的高分子化合物 |
D、1mol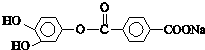 与足量的NaOH溶液加热充分反应,最多能消耗4mol NaOH 与足量的NaOH溶液加热充分反应,最多能消耗4mol NaOH |
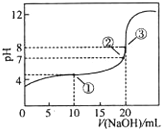 在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol?L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,正确的是( )
在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol?L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,正确的是( )| A、该中和滴定过程,最宜用石蕊作指示剂 |
| B、图中点②所示溶液中,c(CH3COO-)=c(Na+) |
| C、图中点①所示溶液中水的电离程度大于点③所示溶液中水的电离程度 |
| D、滴定过程中的某点,会有c(Na+)>c(CH3COO-)>c(H+)>c(OH-)的关系存在 |
下列化学过程及其表述正确的是( )
| A、向NaHSO4溶液中滴入Ba(OH)2溶液至中性H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| B、由水电离的c(H+)为10-3mol?L-1的溶液中,Na+、NO3-、SO32-、Cl-定能大量共存 |
| C、酸碱中和滴定时,盛装标准液的滴定管滴定前无气泡,终点读数时有气泡,导致计算结果偏低 |
| D、可以用浓盐酸酸化的KMnO4溶液与H2O2混合,以证明H2O2具有还原性2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
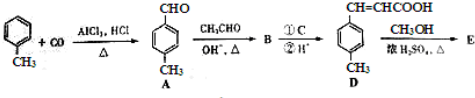
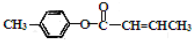 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为


