题目内容
16.下列说法正确的是( )| A. | 原子最外层电子数等于或大于3的元素一定是主族元素 | |
| B. | 原子最外层只有1个电子的元素一定是第IA族元素 | |
| C. | 最外层电子数比次外层电子数多的元素一定位于第二周期 | |
| D. | 某元素的离子最外层电子数与次外层电子数相同,该元素一定位于第三周期 |
分析 A.副族元素最外层有1-2个电子,稀有气体的最外层电子数为2或8;
B.原子最外层只有1个电子的元素,可能为副族元素;
C.每层容纳的电子为2n2个,无论哪层为最外层时,最外层电子不超过8个;
D.某元素的离子最外层电子数与次外层电子数相同,可能为第四周期的金属阳离子.
解答 解:A.副族元素最外层有1-2个电子,稀有气体的最外层电子数可为8,则原子最外层电子数等于或大于3的元素不一定是主族元素,故A错误;
B.原子最外层只有1个电子的元素,可能为副族元素,如副族元素Cr,故B错误;
C.每层容纳的电子为2n2个,无论哪层为最外层时,最外层电子不超过8个,显然外层电子数比次外层电子数多的元素一定位于第二周期,故C正确;
D.某元素的离子最外层电子数与次外层电子数相同,该元素不一定位于第三周期,可能为第四周期的K、Ca等,故D错误;
故选C.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、周期表的结构为解答的关键,侧重分析与应用能力的考查,注意副族元素的电子排布,题目难度不大.

练习册系列答案
相关题目
6. 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | 简单离子半径:T>R |
7.为证明化学反应有一定的限度,进行如下探究活动:
I.取5mL 0.1mol/L的KI溶液,滴加5-6滴FeCl3稀溶液;
Ⅱ.继续加入2mL CCl4,盖好玻璃塞,振荡静置.
Ⅲ.取少量分液后得到的上层清液,滴加KSCN溶液.
Ⅳ.移取25.00mLFeCl3稀溶液至锥形瓶中,加入KSCN溶液用作指示剂,再用c mol/LKI标准溶液滴定,达到滴定终点.重复滴定三次,平均耗用c mol/LKI标准溶液VmL.
(1)探究活动I中发生反应的离子方程式为2Fe3++2I-=2Fe2++I2 .
请将探究活动Ⅱ中“振荡静置”后得到下层液体的操作补充完整:将分液漏斗放在铁架台上,静置.
待液体分层后,将分液漏斗颈上的玻璃塞打开,或使玻璃塞上的凹槽(或小孔)对准分液漏斗上的小孔,再将分液漏斗下面的活塞拧开,使下层液体慢慢沿烧杯壁流下.
(2)探究活动Ⅲ的意图是通过生成红色的溶液(假设溶质全部为Fe(SCN)3),验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈红色.对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察.
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,密度为0.71g/mL,Fe(SCN)3在乙醚中的溶解度比在水中大;
信息二:Fe3+可与[Fe(CN)6]4-反应生成暗蓝色沉淀,用K4[Fe(CN)6](亚铁氰化钾)溶液检验Fe3+的灵敏度比用KSCN溶液更高.
结合新信息,现设计以下实验方案验证猜想:
①请完成如表
②写出实验操作“步骤一”中的反应离子方程式:4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓.
(3)根据探究活动Ⅳ,FeCl3稀溶液物质的量浓度为0.04cVmol/L.
I.取5mL 0.1mol/L的KI溶液,滴加5-6滴FeCl3稀溶液;
Ⅱ.继续加入2mL CCl4,盖好玻璃塞,振荡静置.
Ⅲ.取少量分液后得到的上层清液,滴加KSCN溶液.
Ⅳ.移取25.00mLFeCl3稀溶液至锥形瓶中,加入KSCN溶液用作指示剂,再用c mol/LKI标准溶液滴定,达到滴定终点.重复滴定三次,平均耗用c mol/LKI标准溶液VmL.
(1)探究活动I中发生反应的离子方程式为2Fe3++2I-=2Fe2++I2 .
请将探究活动Ⅱ中“振荡静置”后得到下层液体的操作补充完整:将分液漏斗放在铁架台上,静置.
待液体分层后,将分液漏斗颈上的玻璃塞打开,或使玻璃塞上的凹槽(或小孔)对准分液漏斗上的小孔,再将分液漏斗下面的活塞拧开,使下层液体慢慢沿烧杯壁流下.
(2)探究活动Ⅲ的意图是通过生成红色的溶液(假设溶质全部为Fe(SCN)3),验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈红色.对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察.
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,密度为0.71g/mL,Fe(SCN)3在乙醚中的溶解度比在水中大;
信息二:Fe3+可与[Fe(CN)6]4-反应生成暗蓝色沉淀,用K4[Fe(CN)6](亚铁氰化钾)溶液检验Fe3+的灵敏度比用KSCN溶液更高.
结合新信息,现设计以下实验方案验证猜想:
①请完成如表
| 实验操作 | 现象和结论 |
| 步骤一:取萃取后得到的上层清液,加入2滴K4[Fe(CN)6](亚铁氰化钾)溶液 | 若产生暗蓝色沉淀,则猜想一不成立. |
| 步骤二:取探究Ⅲ中所得溶液,加入少量乙醚,充分振荡,静置分层 | 若乙醚层呈红色,则猜想二成立. |
(3)根据探究活动Ⅳ,FeCl3稀溶液物质的量浓度为0.04cVmol/L.
4.在常温下,把一个盛有一定量甲烷和氯气的密闭玻璃容器放在光亮的地方,两种气体发生反应,下列叙述中不正确的是( )
| A. | 容器内原子总数不变 | B. | 容器内压强不变 | ||
| C. | 容器内分子总数不变 | D. | 发生的反应属于取代反应 |
1.表是A、B两种有机物的有关信息:
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称是1,2二溴乙烷.
(2)A与氢气发生加成反应后生成分子C,与C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是bc(填序号)
a.无色无味液体 b.有毒 c.不溶于水 d.密度比水大 e.能使酸性KMnO4溶液和溴水褪色 f.任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: .
.
| A | B |
| ①能使溴的四氯化碳溶液褪色; ②比例模型:  ③能与水在一定条件下反应 | ①由C、H两种元素组成; ②球棍模型为  |
(1)A与溴的四氯化碳溶液反应的生成物的名称是1,2二溴乙烷.
(2)A与氢气发生加成反应后生成分子C,与C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是bc(填序号)
a.无色无味液体 b.有毒 c.不溶于水 d.密度比水大 e.能使酸性KMnO4溶液和溴水褪色 f.任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 .
.
8.下列关于确定官能团的方法不正确的是( )
| A. | 加入NaHCO3溶液产生气体,表示含有-COOH或酚羟基 | |
| B. | 遇浓硝酸变黄,则表明该物质是含有苯环结构的蛋白质 | |
| C. | 加入新制的Cu(OH)2悬浊液,加热煮沸有红色沉淀生成,或加入银氨溶液加热有银镜生成,表示含有-CHO | |
| D. | 某有机物与醋酸反应,相对分子质量增加42,则含有1个-OH;增加84,则含有2个-OH |
6.下列化合物的核磁共振氢谱中出现一组峰的是( )
| A. | 2,2,3,3一四甲基丁烷 | B. | 2,3,4一三甲基戊烷 | ||
| C. | 3,4一二甲基己烷 | D. | 2,5一二甲基己烷 |
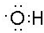 ;
;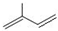 ;
;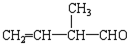 所含官能团的名称是碳碳双键、醛基;该有机物发生加聚反应后,所得产物的结构简式为
所含官能团的名称是碳碳双键、醛基;该有机物发生加聚反应后,所得产物的结构简式为 .
.