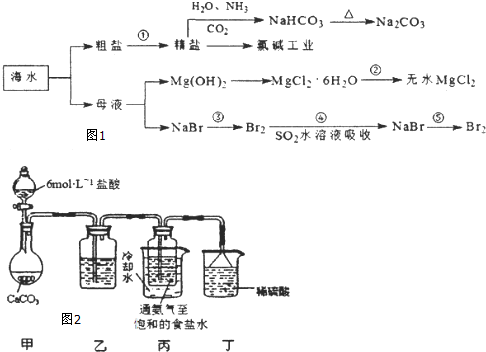
题目内容
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SO2组成,由蛇纹石制取碱式碳酸镁的实验步骤如图1:
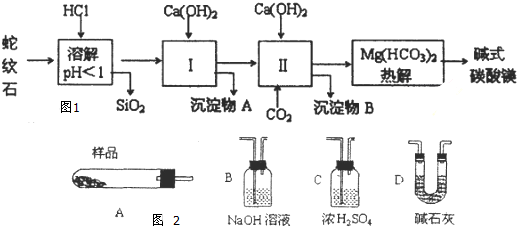
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是 .
(2)进行I操作时,控制溶液的pH=7.8(有关氢氧化物沉淀的pH见下表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致 溶解,产生 沉淀.
(3)从沉淀混合物A中提取红色氧化物作为颜料,先向沉淀物A中加入(填所加物质的化学式),然后 、 、灼烧(填实验操作名称).灼烧操作需在 中进行(填写仪器名称),上述实验中,可以循环利用的物质是 (填化学式).
(4)现设计实验,确定产品aMgCO3?bMg(OH)2?cH2O中a、b、c的值,请写出下列实验步骤中所需要测定的项目(可用试剂:浓硫酸、碱石灰、氢氧化钠溶液、澄清石灰水):①样品称量,②高温分解,③测出水蒸气的质量,④ ,⑤称量MgO的质量.
(5)从下列仪器图2中(装有必要的试剂)中选择完成上述实验所必需的仪器,连接一套装置 (选择仪器代号,可重复使用,用“A→B→…→”表示)
(6)18.2g产品完全分解后.产生6.6gCO2和8.OgMgO,由此可知,产品的化学式中 a= ,b= ,c= .

(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是
(2)进行I操作时,控制溶液的pH=7.8(有关氢氧化物沉淀的pH见下表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.9 | 3.3 | 9.4 |
沉淀完全时PH | 3.2 | 5.4 | 12.4 |
(4)现设计实验,确定产品aMgCO3?bMg(OH)2?cH2O中a、b、c的值,请写出下列实验步骤中所需要测定的项目(可用试剂:浓硫酸、碱石灰、氢氧化钠溶液、澄清石灰水):①样品称量,②高温分解,③测出水蒸气的质量,④
(5)从下列仪器图2中(装有必要的试剂)中选择完成上述实验所必需的仪器,连接一套装置
(6)18.2g产品完全分解后.产生6.6gCO2和8.OgMgO,由此可知,产品的化学式中 a=
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)蛇纹石矿可以看做MgO、Fe2O3、Al2O3、SiO2组成,蛇纹石加盐酸溶解后,MgO、Fe2O3、Al2O3和HCl反应溶解,而SiO2和HCl不反应,不能溶解;
(2)当氢氧化钙过量时,溶液碱性增强,Al(OH)3会溶解,从氢氧化物沉淀的pH表中可看出,Mg(OH)2在pH为9.4时开始沉淀,所以碱性增强Mg(OH)2会沉淀;
(3)红色氧化物为Fe2O3,应先将其中含有的少量Al(OH)3除去,除去Al(OH)3的方法是利用它能溶于强碱的性质;此过程中CO2是可以重复使用的;
(4)利用浓硫酸的吸水性干燥,再称量碱石灰吸收CO2前后的质量;
(5)加热用A,吸收水蒸气用浓硫酸,用碱石灰吸收二氧化碳;
(6)确定产品aMgCO3?bMg(OH)2?cH2O中a、b、c的值,需要测定的数据是①样品质量;②MgO质量;③生成CO2的质量(或体积);④生成水的质量.
(2)当氢氧化钙过量时,溶液碱性增强,Al(OH)3会溶解,从氢氧化物沉淀的pH表中可看出,Mg(OH)2在pH为9.4时开始沉淀,所以碱性增强Mg(OH)2会沉淀;
(3)红色氧化物为Fe2O3,应先将其中含有的少量Al(OH)3除去,除去Al(OH)3的方法是利用它能溶于强碱的性质;此过程中CO2是可以重复使用的;
(4)利用浓硫酸的吸水性干燥,再称量碱石灰吸收CO2前后的质量;
(5)加热用A,吸收水蒸气用浓硫酸,用碱石灰吸收二氧化碳;
(6)确定产品aMgCO3?bMg(OH)2?cH2O中a、b、c的值,需要测定的数据是①样品质量;②MgO质量;③生成CO2的质量(或体积);④生成水的质量.
解答:
解:(1)蛇纹石加盐酸溶解,MgO、Fe2O3、Al2O3和HCl反应溶解,反应方程式分别为:MgO+2HCl=MgCl2+H2O,Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O.而SiO2不与盐酸反应,以沉淀的形式除去.故答案为:Fe3+、Al3+;
(2)由(1)知,此时溶液中除了Mg2+外,还含有Fe3+、Al3+杂质,需除去Fe3+、Al3+但不能损失Mg2+,因Fe3++3H2O?Fe(OH)3+3H+和Al3++3H2O?Al(OH)3+3H+,利用平衡移动的原理,消耗H+使上述水解平衡向正反应方向移动,除去Fe3+、Al3+,加Ca(OH)2需将溶液的pH控制在7~8,若pH过高,会导致生成的Al(OH)3发生反应Al(OH)3+OH-=AlO2-+2H2O溶解,Mg(OH)2在pH为9.4时开始沉淀,所以碱性增强Mg(OH)2会沉淀,同时Mg2+也因转化为沉淀而损失.
故答案为:Al(OH)3 Mg(OH)2;
(3)从实验步骤图知:沉淀混合物为Fe(OH)3和Al(OH)3,红色氧化物是沉淀物Fe(OH)3分解后得到的Fe2O3,所以得先加碱把Al(OH)3除掉,反应为:Al(OH)3+NaOH=NaAlO2+2H2O,然后过滤洗涤灼烧即可;从实验步骤图知:上述实验中,步骤Ⅱ中通二氧化碳,生成碳酸钙,碳酸钙分解可得到二氧化碳,作为第Ⅱ步的原料,碱式碳酸镁分解得到CO2,可以循环使用的物质是CaCO3或CO2.
故答案为:NaOH或Ca(OH)2;过滤;洗涤;坩埚;CO2;
(4)利用碱石灰吸收CO2前后的质量差求二氧化碳质量,故答案为:测出二氧化碳的质量;
(5)加热用A,吸收水蒸气用浓硫酸,用碱石灰吸收二氧化碳,第二个碱石灰可防止空气中的二氧化碳和水进入装置,故答案为:A→C→D→D;
(6)m(样品)=18.2g,m(CO2)=6.6g,m(MgO)=8.0g,碱式碳酸镁分解:aMgCO3?bMg(OH)2?cH2O
(a+b)MgO+aCO2↑+(b+c)H2O↑,根据质量守恒得:m(H2O)=18.2g-6.6g-8.0g=3.6g,则m(MgO)═0.2mol,n(CO2)═0.15mol,n(H2O)═0.2mol,得:a:b:c=0.15:0.05:0.15=3:1:3,故答案为:3,1,3.
(2)由(1)知,此时溶液中除了Mg2+外,还含有Fe3+、Al3+杂质,需除去Fe3+、Al3+但不能损失Mg2+,因Fe3++3H2O?Fe(OH)3+3H+和Al3++3H2O?Al(OH)3+3H+,利用平衡移动的原理,消耗H+使上述水解平衡向正反应方向移动,除去Fe3+、Al3+,加Ca(OH)2需将溶液的pH控制在7~8,若pH过高,会导致生成的Al(OH)3发生反应Al(OH)3+OH-=AlO2-+2H2O溶解,Mg(OH)2在pH为9.4时开始沉淀,所以碱性增强Mg(OH)2会沉淀,同时Mg2+也因转化为沉淀而损失.
故答案为:Al(OH)3 Mg(OH)2;
(3)从实验步骤图知:沉淀混合物为Fe(OH)3和Al(OH)3,红色氧化物是沉淀物Fe(OH)3分解后得到的Fe2O3,所以得先加碱把Al(OH)3除掉,反应为:Al(OH)3+NaOH=NaAlO2+2H2O,然后过滤洗涤灼烧即可;从实验步骤图知:上述实验中,步骤Ⅱ中通二氧化碳,生成碳酸钙,碳酸钙分解可得到二氧化碳,作为第Ⅱ步的原料,碱式碳酸镁分解得到CO2,可以循环使用的物质是CaCO3或CO2.
故答案为:NaOH或Ca(OH)2;过滤;洗涤;坩埚;CO2;
(4)利用碱石灰吸收CO2前后的质量差求二氧化碳质量,故答案为:测出二氧化碳的质量;
(5)加热用A,吸收水蒸气用浓硫酸,用碱石灰吸收二氧化碳,第二个碱石灰可防止空气中的二氧化碳和水进入装置,故答案为:A→C→D→D;
(6)m(样品)=18.2g,m(CO2)=6.6g,m(MgO)=8.0g,碱式碳酸镁分解:aMgCO3?bMg(OH)2?cH2O
| ||
点评:本题主要考查了元素化合物中金属铝、铁的性质,解题时不仅需熟知物质间的反应原理,还需灵活运用于实验的设计,难度中等.

练习册系列答案
相关题目
对于合成氨工业来说,下列叙述中正确的是( )
| A、使用催化剂和施加高压,都能提高反应速率,都对化学平衡状态无影响 |
| B、使用催化剂和施加高压,都能提高反应速率,只有压强对化学平衡状态有影响 |
| C、采用循环操作,能提高NH3的平衡浓度 |
| D、采用循环操作,能加快反应速率 |
用如图所示装置进行实验,装置正确且设计合理的是( )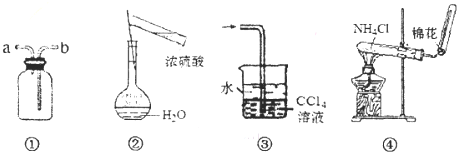

| A、装置①可用于排空气法收集NO气体 |
| B、可用图②所示装置及操作配制一定物质的量浓度的硫酸 |
| C、装置③可用于吸收氯化氢或氨气 |
| D、实验室可用装置④制取NH3 |
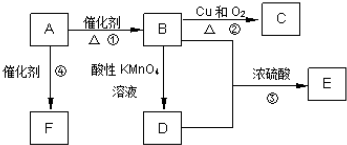
M、N、X、Y四种物质有如下转化关系(反应条件和其他产物已省略),下列选项不可能的是( )
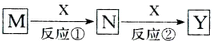

| A、M:Na X:O2 |
| B、M:HNO3 X:Fe |
| C、M:Al X:NaOH |
| D、M:NH3 X:O2 |
在配制Fe2(SO4)3溶液时,为了抵制水解,常常往溶液中加入少量的:( )
| A、H2SO4 |
| B、NaOH |
| C、KCl |
| D、CH3COOH |