题目内容
17.接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行;2SO2(g)+O2(g)?2SO3(g),每生成2mol SO3 放出190kJ的热量(1)下列描述中能说明上述反应已达平衡的是bd
a.υ(O2)正=2υ(SO3)逆
b.容器中气体的相对分子质量不随时间而变化
c.定容容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(2)向容器中通入2mol SO2 和1mol O2,使之反应.反应达到平衡后,放出热量为A.
A.小于190KJ B.等于 190KJ
C.大于190KJ D.可能大于或小于或等于190KJ.
分析 (1)根据化学平衡状态的标志:正反应速率等于逆反应速率,平衡混合物中各组成成分的含量不变来判断;
(2)2mol SO2和1molO2完全反应生成2molSO3气体放出热量为190kJ,2SO2(g)+O2(g)?2SO3(g)为可逆反应,向密闭容器中通入2molSO2和1molO2,反应达到平衡时,生成SO3的物质的量小于2mol,放出的热量与生成SO3的物质的量呈正比.
解答 解:(1)a.υ(O2)正=2υ(SO3)逆,速率之比不等于化学计量数之比,故错误;
b.容器中气体的相对分子质量不随时间而变化,说明气体的物质的物质的量不变,反应达平衡状态,故正确;
c.定容容器中气体的密度一直不随时间而变化,说明反应不一定达平衡状态,故错误;
d.容器中气体的分子总数不随时间而变化,说明气体的物质的量不变反应达平衡状态,故正确;
故选:bd;
(2)2mol SO2和1molO2完全反应生成2molSO3气体放出热量为190kJ,2SO2(g)+O2(g)?2SO3(g)为可逆反应,反应不能进行到底,向密闭容器中通入2molSO2和1molO2,反应达到平衡时,生成SO3的物质的量小于2mol,故平衡时放出的热量小于190kJ,所以Q<190 kJ,故选:A.
点评 本题考查化学平衡状态的判断和可逆反应特点、热化学方程式等,难度不大,理解热化学方程式表示的含义是解题关键.

练习册系列答案
相关题目
9.若阿伏加德罗常数的数值为NA,则下列说法中正确的是( )
| A. | 1 molFe与过量的氯气反应,转移电子的数目为2 NA | |
| B. | 2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA | |
| C. | 1.0L0.1 mol•L-1Na2S溶液中含有的S2-离子数小于0.1NA | |
| D. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
6.下列实验现象描述正确的是( )
| A. | 红磷在空气中燃烧:发出白光,生成大量的白色烟雾 | |
| B. | 碳酸钠溶液与氢氧化钙溶液反应:溶液中产生气泡 | |
| C. | 氢气在空气中燃烧:无色气体燃烧,发出淡蓝色火焰,放热 | |
| D. | 镁条在空气中燃烧:银白色固体燃烧,生成白色固体氧化镁 |
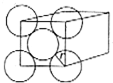 金晶体是面心立方最密堆积,立方体的每个面上5个金原子紧密堆砌(如图,其余各面省略),金原子半径为A cm,求:
金晶体是面心立方最密堆积,立方体的每个面上5个金原子紧密堆砌(如图,其余各面省略),金原子半径为A cm,求:
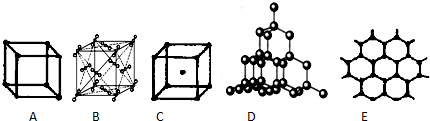
 .一定条件下,硫与地壳中含量最多的非金属元素X可组成两种常见的化合物,则X是O,两种化合物均含有的化学键为共价键
.一定条件下,硫与地壳中含量最多的非金属元素X可组成两种常见的化合物,则X是O,两种化合物均含有的化学键为共价键
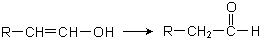
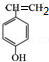
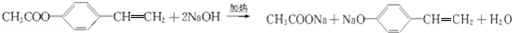 .
.