题目内容
有A、B、C三种含钠元素的白色固体,均能溶于水.A和B的水溶液反应生成C,加热B固体产生无色无味的气体X,将X通入CaCl2溶液中无现象,通入澄清石灰水中产生白色沉淀.A的水溶液有强腐蚀性,气体X与C的水溶液反应可得到B,过量A与X反应得到C,A不足时与X反应得到B.
(1)判断A为 ,B为 ,C为 .
(2)写出以下化学方程式:A+B→C: B受热分解生成气体X: .
(1)判断A为
(2)写出以下化学方程式:A+B→C:
考点:无机物的推断
专题:推断题
分析:加热B固体产生无色无味的气体X,将X通入CaCl2溶液中无现象,通入澄清石灰水中产生白色沉淀,说明B为NaHCO3,X为CO2,A的水溶液有强腐蚀性,A为NaOH,气体X与C的水溶液反应可得到B,说明C为Na2CO3,依此解答.
解答:
解:加热B固体产生无色无味的气体X,将X通入CaCl2溶液中无现象,通入澄清石灰水中产生白色沉淀,说明B为NaHCO3,X为CO2,A的水溶液有强腐蚀性,A为NaOH,气体X与C的水溶液反应可得到B,说明C为Na2CO3,
(1)由上分析,A为 NaOH,B为 NaHCO3,C为 Na2CO3,故答案为:NaOH;NaHCO3;Na2CO3;
(2)NaOH与NaHCO3反应生成 Na2CO3的方程式为NaOH+NaHCO3=Na2CO3+H2O,NaHCO3受热分解生成Na2CO3、H2O和CO2,方程式为2NaHCO3
Na2CO3+H2O+CO2↑,
故答案为:NaOH+NaHCO3=Na2CO3+H2O;2NaHCO3
Na2CO3+H2O+CO2↑.
(1)由上分析,A为 NaOH,B为 NaHCO3,C为 Na2CO3,故答案为:NaOH;NaHCO3;Na2CO3;
(2)NaOH与NaHCO3反应生成 Na2CO3的方程式为NaOH+NaHCO3=Na2CO3+H2O,NaHCO3受热分解生成Na2CO3、H2O和CO2,方程式为2NaHCO3
| ||
故答案为:NaOH+NaHCO3=Na2CO3+H2O;2NaHCO3
| ||
点评:本题考查了无机物的推断,明确物质的性质及特殊性质是解本题关键,同时考查学生知识综合运用能力,难度不大.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、金属钠溶于水:2Na+2H2O=2Na++2OH-+H2↑ |
| B、Cl2与H2O反应:Cl2+H2O=2H++Cl-+ClO- |
| C、硫酸铜溶液与氢氧化钡溶液反应:Cu2++2OH-=Cu(OH)2↓ |
| D、铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
对于3Fe(s)+4H2O(g)
Fe3O4(s)+4H2(g),反应的化学平衡常数的表达式为( )
| ||
A、K=
| ||
B、K=
| ||
C、K=
| ||
D、K=
|
用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来溶液完全一样的是( )
| A、CuCl2(CuSO4) |
| B、AgNO3(H2O) |
| C、NaCl(盐酸) |
| D、CuSO4(CuO) |

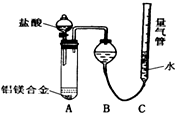 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定已知质量的铝镁合金(设不含其它元素)中镁的质量分数,设计下列三种不同实验方案(所加试剂均为足量)进行探究.填写下列空白.
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定已知质量的铝镁合金(设不含其它元素)中镁的质量分数,设计下列三种不同实验方案(所加试剂均为足量)进行探究.填写下列空白.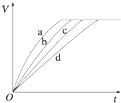 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得如图,则曲线a、b、c、d所对应的实验组别可能是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得如图,则曲线a、b、c、d所对应的实验组别可能是( )


