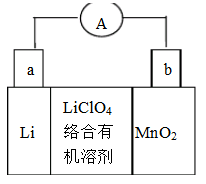
题目内容
蓄电池放电时是起原电池的作用,在充电时起电解池的作用。下式是爱迪生蓄电池分别在充电、放电时的反应: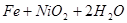

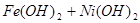 ,下列有关爱迪生电池的各种推断中错误的是( )。
,下列有关爱迪生电池的各种推断中错误的是( )。
A.放电时铁做负极, 做正极 做正极 |
B.充电时阴极上的电极反应为: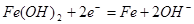 |
| C.放电时,电解质溶液中的阴离子是向正极方向移动 |
| D.蓄电池的两个电极必须浸入在碱性溶液中 |
C
解析试题分析:根据电池总反应可知,放电时,Fe被氧化生成Fe(OH)2,电极反应式为Fe-2e-+2OH-=Fe(OH)2。正极NiO2得电子被还原生成Ni(OH)2,电极反应式为NiO2+2H2O+2e-=Ni(OH)2+2OH-。充电时电能转化为化学能,电极反应与原电池电极反应相反,以此解答该题。
放电时,Fe被氧化生成Fe(OH)2,为原电池的负极,NiO2是正极,故A正确;充电时阴极发生还原反应,Fe(OH)2被还原生成铁,电极反应为Fe(OH)2+2e-=Fe+2OH-,故B正确;放电时,电解质溶液中的阳离子是向正极方向移动,故C错误;该蓄电池在碱性条件下进行,电解质溶液应为碱性溶液,如用酸性电解质,则会破坏电池,故D正确,答案选C。
考点:考查爱迪生蓄电池的有关判断
点评:该题是高考中的常见题型,属于中等难度的试题,试题贴近高考,有利于激发学生的学习兴趣。该题的关键是明确原电池和电解池的工作原理,然后结合题意灵活运用即可。答题注意根据电池总反应能正确书写电极反应式,为解答此类题目的关键,也是易错点。

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案下列实验现象预测正确的是
| A.实验I:电流表A指针偏转,碳棒上有红色固体析出 |
| B.实验II:电流表A指针偏转,铁极上有无色气体产生 |
| C.实验III:碳棒上有无色气体产生,铁极上有黄绿色气体产生 |
| D.实验IV:粗铜溶解,精铜上有红色固体析出 |
如下图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )
| A.装置中出口①处的物质是氯气,出口②处的物质是氢气 |
| B.该离子交换膜只能让阳离子通过,不能让阴离子通过 |
C.装置中发生反应的离子方程式为:2Cl-+2H+ Cl2↑+H2↑ Cl2↑+H2↑ |
| D.该装置是将电能转化为化学能 |
在理论上可用来设计原电池的反应是
| A.Fe +2HCl =" Fe" Cl2+ H2 |
| B.NaOH +HCl="NaCl+" H2O |
| C.Cu SO4 +2NaOH= Cu(OH)2+Na2 SO4 |
| D.Ca CO3+2HCl=" Ca" Cl2+ H2O+ CO2 |
利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来.下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.该电池工作时,有关说法正确的是 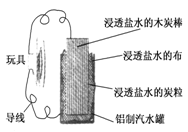
| A.炭棒应与玩具电机的负极相连 |
| B.炭粒和炭棒上发生的反应为:O2+4e-=2O2- |
| C.铝罐将逐渐被腐蚀 |
| D.该电池工作一段时间后炭棒和炭粒的质量会减轻 |
在化学能与电能的转化过程中,下列叙述正确的是 ( )
| A.电解饱和食盐水时,阳极得到Cl2 和NaOH(aq) |
| B.教材所示的铜-锌原电池在工作时,Zn2+ 向铜片附近迁移 |
| C.电镀时,电镀槽里的负极材料发生氧化反应 |
| D.原电池与电解池连接后,电子从原电池负极流向电解池阳极 |
原电池的电极名称不仅与电极的性质有关,也与电解质溶液有关,下列说法中不正确的是
| A.有Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3 e-=Al3+ |
| B.Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3 e-=Al3+ |
| C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Fe-2e-═Fe2+, |
| D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
 Fe2++H2↑。
Fe2++H2↑。