题目内容
下列实验现象预测正确的是
| A.实验I:电流表A指针偏转,碳棒上有红色固体析出 |
| B.实验II:电流表A指针偏转,铁极上有无色气体产生 |
| C.实验III:碳棒上有无色气体产生,铁极上有黄绿色气体产生 |
| D.实验IV:粗铜溶解,精铜上有红色固体析出 |
AD
解析试题分析:由于Fe比C活泼,铁与硫酸铜溶液能发生置换反应,则I为原电池,Fe是负极,C是正极,电子从Fe流出经过导线、电流计流入C,溶液中的Cu2+移向正极,并在正极上得到电子,发生还原反应,生成单质铜,故A选项正确;II是原电池,Fe是负极,本身失去电子,发生氧化反应,被腐蚀,负极反应式为Fe—2e—=Fe2+,C是正极,由于NaCl是强酸强碱盐,其溶液呈中性,因此属于铁的吸氧腐蚀,则正极反应式为O2+4e—+2H2O=4OH—,故B选项错误;III是电解池,也是外加电流的阴极保护法,C是阳极,溶液中的氯离子和氢氧根离子移向碳棒,氯离子容易在阳极上失去电子,发生氧化反应,生成氯气,氯气是黄绿色气体,Fe是阴极,溶液中的钠离子和氢离子移向铁棒,氢离子容易在阴极上得到电子,发生还原反应,生成氢气,氢气是无色气体,故C选项错误;IV是电解精炼铜,粗铜作阳极,发生氧化反应,逐渐溶解,精铜作阴极,溶液中的铜离子移向阴极,并在精铜上得到电子,发生还原反应,生成单质铜,单质铜是红色固体,故D选项正确。
考点:考查原电池和电解原理及其应用,涉及原电池、钢铁的吸氧腐蚀、钢铁的电化学防护方法、电解精炼铜等实验装置的识别、实验预期现象及结论的判断等。

有关钢铁电化学腐蚀及保护的下列叙述中正确的是
| A.钢铁的电化学腐蚀过程可用原电池或电解池的原理来解释 |
| B.可将河道中的钢铁闸门与外加直流电源的负极相连以保护其不受腐蚀 |
| C.在钢铁表面镀锌属于牺牲阳极阴极保护法 |
| D.钢铁的电化学腐蚀中,主要是吸氧腐蚀 |
镍铬(Ni-Cd)可充电电池的电解质溶液为KOH溶液,它的充、放电反应按下式进行:
Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2;已知Ni(OH)2、Cd(OH)2和
Cd(OH)2 + 2Ni(OH)2;已知Ni(OH)2、Cd(OH)2和
NiOOH都不溶于KOH溶液。则下列有关电极反应式正确的是
| A.放电时负极:Cd-2e-=Cd2+ |
| B.放电时正极:2NiOOH + 2e- + 2H2O=2Ni(OH)2 + 2OH- |
| C.充电时阳极:2Ni(OH)2-2e-+ 4H+=2Ni3+ + 4H2O |
| D.充电时阴极:Cd(OH)2 + 2e-=Cd + 2OH- |
如图所示的装置,通电一段时间后,测得甲池中某电极质量增加2.16 g,乙池中某电极上析出0.64 g某金属,下列说法正确的是
| A.甲池b极上析出金属银,乙池c极上析出某金属 |
| B.甲池a极上析出金属银,乙池d极上析出某金属 |
| C.某盐溶液可能是CuSO4溶液 |
| D.某盐溶液可能是Mg(NO3)2溶液 |
关于下列各图的说法,正确的是
| A.①中阴极处能产生使湿润淀粉KI试纸变蓝的气体 |
| B.②中待镀铁制品应与电源正极相连 |
| C.③中电子由b极流向a极 |
| D.④中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |
下一代iPhone将在电池方面有所改进,该电池的一极为一种有机高分子游离基(用R表示)和石墨粉及粘结剂的复合材料,另一极是锂,分隔材料为某种聚烯烃,电解质为LiPF6溶解于某种有机碳酸酯溶剂中。该游离基(R)在空气中十分稳定,在充电时被氧化成阳离子(Rx+),电池充放电的方程式为:xLi+Rx+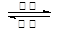 xLi++R。下列有关说法正确的是
xLi++R。下列有关说法正确的是
| A.放电时,该电池将电能转化为化学能 | B.充电时,Rx+由阴极向阳极移动 |
| C.放电时,负极反应为xLi-xe-==xLi+ | D.充电时,阳极反应为R-xe-==Rx+ |
关于如图装置的叙述,不正确的是( )
| A.铝是负极,铝片上析出无色气体 |
| B.石墨是正极,石墨棒上析出黄绿色气体 |
| C.溶液中两电极间产生白色沉淀 |
| D.溶液中Na+向石墨方向移动 |
某同体酸燃料电池以Ca(HSO )
)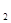 固体为电解质传递H
固体为电解质传递H ,其基本结构如图所示,电池总反应可表示为:2H
,其基本结构如图所示,电池总反应可表示为:2H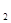 +O
+O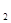 =2H
=2H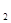 O,下列有关说法错误的是
O,下列有关说法错误的是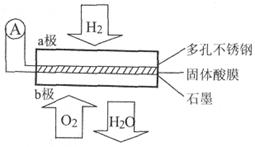
| A.电子通过外电路从a极流向b极 |
B.b极上的电极反应式为:O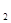 +4H +4H +4e +4e =2H =2H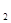 O O |
| C.每转移0.4 mol电子,生成3.6g水 |
D.H 由b极通过固体酸电解质传递到a极 由b极通过固体酸电解质传递到a极 |
蓄电池放电时是起原电池的作用,在充电时起电解池的作用。下式是爱迪生蓄电池分别在充电、放电时的反应: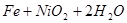

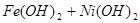 ,下列有关爱迪生电池的各种推断中错误的是( )。
,下列有关爱迪生电池的各种推断中错误的是( )。
A.放电时铁做负极, 做正极 做正极 |
B.充电时阴极上的电极反应为: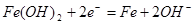 |
| C.放电时,电解质溶液中的阴离子是向正极方向移动 |
| D.蓄电池的两个电极必须浸入在碱性溶液中 |