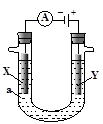题目内容
利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来.下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.该电池工作时,有关说法正确的是 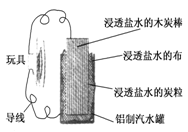
| A.炭棒应与玩具电机的负极相连 |
| B.炭粒和炭棒上发生的反应为:O2+4e-=2O2- |
| C.铝罐将逐渐被腐蚀 |
| D.该电池工作一段时间后炭棒和炭粒的质量会减轻 |
C
解析试题分析:碳棒、铝罐和食盐水构成了原电池,较活泼的金属铝作负极,导电的非金属碳棒作正极。负极上铝失电子发生氧化反应,正极上溶解在水中的氧气得电子发生还原反应;原电池放电时,正极应与玩具电机的正极相连。
碳棒作原电池的正极,所以应与玩具电机的正极相连,故A错误;碳棒、铝罐和食盐水构成了原电池,较活泼的金属铝作负极,导电的非金属碳棒作正极,2H2O+O2+4e-=4OH-,故B错误;碳棒、铝罐和食盐水构成了原电池,较活泼的金属铝作负极,铝失电子生成铝离子,所以铝罐逐渐被腐蚀,故C正确;在原电池工作时,炭棒作正极,电极反应式为2H2O+O2+4e-=4OH-,由此可知炭棒和碳粒的质量不会改变,故D错误,答案选C。
考点:考查原电池原理的有关判断和应用
点评:该题是高考中的常见题型,属于中等难度的试题。该题的关键是明确原电池的工作愉快,然后结合题意和装置图灵活运用即可。易错选项是A,注意原电池负极应与玩具电机的负极相连,原电池正极与玩具电机的正极相连。

关于下列各图的说法,正确的是
| A.①中阴极处能产生使湿润淀粉KI试纸变蓝的气体 |
| B.②中待镀铁制品应与电源正极相连 |
| C.③中电子由b极流向a极 |
| D.④中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |
下列有关金属腐蚀与防护的说法正确的是( )
| A.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阴极的阳极保护法 |
| B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C.纯银器表面在空气中因化学腐蚀渐渐变暗 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
将锌片和铜片用导线连接后放入硫酸铜溶液中,发生原电池反应(反应前后溶液体积不变),在反应过程中,下列叙述错误的是
| A.电子由锌片经导线流向铜片 | B.铜片作正极,锌片作负极 |
| C.溶液中SO42- 的物质的量浓度保持不变 | D.溶液中Cu2+移向负极 |
两种金属A与B和稀硫酸组成原电池时,A是正极。下列有关推断正确的是
| A.A的金属性强于B | B.电子不断由A电极经外电路流向B电极 |
| C.A电极上发生的电极反应是还原反应 | D.A的金属活动性一定排在氢前面 |
蓄电池放电时是起原电池的作用,在充电时起电解池的作用。下式是爱迪生蓄电池分别在充电、放电时的反应: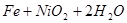

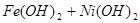 ,下列有关爱迪生电池的各种推断中错误的是( )。
,下列有关爱迪生电池的各种推断中错误的是( )。
A.放电时铁做负极, 做正极 做正极 |
B.充电时阴极上的电极反应为: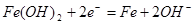 |
| C.放电时,电解质溶液中的阴离子是向正极方向移动 |
| D.蓄电池的两个电极必须浸入在碱性溶液中 |
硝酸汞和碘化钾溶液混合后会生成红色的碘化汞沉淀,为了探究硝酸汞和碘化钾溶液之间能否发生氧化还原反应,研究人员设计了如图的实验装置,结果电流计指针发生了偏转,下列分析正确的是( )
| A.如图装置的电流方向是从C1到C2 |
| B.C1是负极,发生的反应是2I-=I2+2e- |
| C.K+离子向C1电极流动 |
| D.装置发生的总反应是Hg2++2I-=HgI2↓ |