题目内容
11.把pH=3的H2SO4溶液和pH=10的NaOH溶液混合,两者恰好中和.则酸和碱的体积比应是( )| A. | 10:1 | B. | 1:10 | C. | 1:100 | D. | 1:2 |
分析 pH=3的H2SO4溶液中c(H+)=10-3mol/L,pH=10的NaOH溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-10}}$mol/L=10-4mol/L,两溶液恰好中和,则n(H+)=n(OH-),再结合n=cV表示出n(H+)、n(OH-),据此判断.
解答 解:pH=3H2SO4溶液中c(H+)=10-3mol/L,pH=10的NaOH溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-10}}$mol/L=10-4mol/L,两溶液恰好中和,则n(H+)=n(OH-),所以Vac(H+)=Vbc(OH-),所以Va:Vb=c(OH-):c(H+)=10-4mol/L:10-3mol/L=1:10.
故选B.
点评 考查溶液pH值的有关计算、化学方程式计算,比较基础,注意基础知识的掌握.应注意的是恰好完全中和和溶液显中性的区别.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列各化合物的命名中正确的是( )
| A. | 2-甲基-2-丁炔 | B. | 2-乙基丁烷 | C. | 3-丁醇 | D. | 2-甲基-2-丁烯 |
2.在一定温度和压强下40mL的XY2气体和20mL的Y2气体化合成40mL的Z气体,则Z气体的分子式表示为( )
| A. | X2Y4 | B. | XY3 | C. | X2Y6 | D. | X3Y |
3.下列物质的水溶液中存在溶质分子的是( )
| A. | HCl | B. | NaHCO3 | C. | 蔗糖 | D. | NaOH |


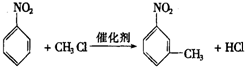 .
.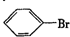 .
. ”中的反应中属于取代反应的是ab,属于加成反应的是c(填字母).
”中的反应中属于取代反应的是ab,属于加成反应的是c(填字母). 的所有原子不是(填“是”或“不是”)在同一平面上.
的所有原子不是(填“是”或“不是”)在同一平面上.