题目内容
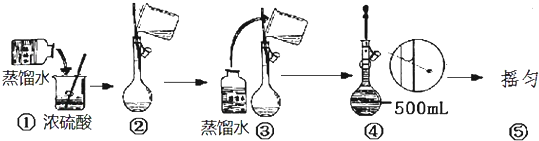
16.1.1736g酒石酸试样,溶解后用NaOH标准溶液[c(NaOH)=0.5046mol/L]滴定至终点,用去29.92mL.空白试验用去同一NaOH标准溶液0.02mL,求此试样中酒石酸的质量分数.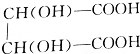 +2NaOH=
+2NaOH=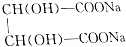 +2H2O.
+2H2O.
分析 空白试验用去同一NaOH标准溶液0.02mL,则中和滴定过程中实际上消耗NaOH体积为29.9mL,根据方程式中酒石酸与NaOH的关系式计算酒石酸质量分数.
解答 解:空白试验用去同一NaOH标准溶液0.02mL,则中和滴定过程中实际上消耗NaOH体积为29.9mL,则消耗n(NaOH)=0.5046mol/L×0.0299L=0.015mol,
根据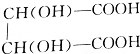 +2NaOH=
+2NaOH=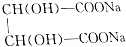 +2H2O知,参加反应的酒石酸的物质的量为NaOH的一半,为0.0075mol,其质量=0.0075mol×150g/mol=1.125g,
+2H2O知,参加反应的酒石酸的物质的量为NaOH的一半,为0.0075mol,其质量=0.0075mol×150g/mol=1.125g,
其质量分数=$\frac{1.125g}{1.1736g}×100%$=95.9%,
答:其质量分数为95.9%.
点评 本题考查化学方程式的有关计算,为高频考点,侧重考查学生分析推断能力,明确“空白实验“含义是解本题关键,明确各个物理量之间的关系即可解答,题目难度不大.

练习册系列答案
相关题目
13.滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等.沉淀滴定所用的指示剂本身就是一种沉淀剂.已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
滴定时,你认为该滴定适宜选用的指示剂是下列中的( )
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
| A. | KBr | B. | KI | C. | K2S | D. | K2CrO4 |
1.下列说法中正确的是( )
| A. | 在相同条件下,将等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多 | |
| B. | 由 C(s,石墨)→C(s,金刚石)-1.9kJ可知,金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)→H2O(l)+57.3kJ,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| D. | 在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)→2H2O(l)+285.8kJ |
8.体积相同、PH也相同的H2SO4溶液和HCl溶液,分别与NaOH溶液中和反应时两者消耗NaOH的物质的量( )
| A. | 相同 | B. | H2SO4溶液消耗的NaOH多 | ||
| C. | HCl溶液消耗的NaOH多 | D. | 无法比较 |
5.热还原法冶炼金属的反应一定是( )
| A. | 置换反应 | B. | 分解反应 | C. | 复分解反应 | D. | 氧化还原反应 |
6.对于1L H2SO4和HNO3的混合溶液,若H2SO4和HNO3物质的量浓度存在如下关系:c(H2SO4)+c(HNO3)=1.2mol•L-1,则理论上最多能溶解铜的物质的量为( )
| A. | 0.80 mol | B. | 0.72 mol | C. | 0.45 mol | D. | 0.40 mol |

 ,由2个原子组成的分子是HCl、由2原子组成具有10电子的阴离子OH-.
,由2个原子组成的分子是HCl、由2原子组成具有10电子的阴离子OH-.