题目内容
20.通过粮食发酵可获得某有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%.(1)X的分子式是C2H6O;
(2)X与金属钠反应放出H2,反应化学方程式是2CH3CH2OH+2Na→2CH3CH2ONa+H2↑(有机物用结构简式表达);
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是CH3CHO;
(4)X与高锰酸钾酸性溶液反应可生成Z.在加热和浓硫酸作用下,X与Z反应可生成一种无色具有水果香味的液体W,装置如图所示:
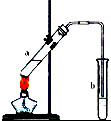 ①生成液体W的化学方程式为CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;
①生成液体W的化学方程式为CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;②为了防止a中液体暴沸,加热前应采取的措施是加入碎瓷片;
③b试管中导管不能伸入到液面以下的理由是防止溶液倒吸;
④试管b中加有饱和Na2CO3溶液,其作用是吸收随乙酸乙酯蒸出的少量酸性物质和乙醇;
⑤若184g X和120g Z反应能生成106g W,则该反应的产率为60.2%.
(已知 $产率=\frac{实际产量}{理论产量}×100%$)
分析 通过粮食发酵可获得某含氧有机物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%,则含氧的质量分数为1-52.2%-13.%=34.8%,则有机物中含C:$\frac{46×52.2%}{12}$=2,含H:$\frac{46×13.0%}{1}$=6,含O:$\frac{46×34.8%}{16}$=1,则分子式为C2H6O,为乙醇,含有羟基,在催化作用下乙醇被氧化生成的Y为乙醛,X与酸性高锰酸钾溶液反应可生成Z.在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W,则Z为CH3COOH,W为CH3COOCH2CH3,为乙酸乙酯的制备,以此解答该题.
解答 解:通过粮食发酵可获得某含氧有机物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%,则含氧的质量分数为1-52.2%-13.%=34.8%,则有机物中含C:$\frac{46×52.2%}{12}$=2,含H:$\frac{46×13.0%}{1}$=6,含O:$\frac{46×34.8%}{16}$=1,则分子式为C2H6O,为乙醇,
(1)由以上分析可知X的分子式为C2H6O,故答案为:C2H6O;
(2)因与钠反应生成H2,所以X为CH3CH2OH,与钠反应方程式为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,
故答案为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y为乙醛,结构简式为CH3CHO,故答案为:CH3CHO;
(4)X与酸性高锰酸钾溶液反应可生成Z.在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W,则Z为CH3COOH,W为CH3COOCH2CH3,为乙酸乙酯的制备,
①乙酸与乙醇发生酯化反应生成乙酸乙酯,该反应的化学方程式为:CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,
故答案为:CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;
②为了防止a中液体暴沸,加热前应在试管中加入碎瓷片,故答案为:加入碎瓷片;
③生成物含有乙醇和乙酸,二者都易溶于水,不能用插入到液面以下,否则产生倒吸现象,故答案为:防止溶液倒吸;
④制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,
故答案为:吸收随乙酸乙酯蒸出的少量酸性物质和乙醇;
⑤乙醇与高锰酸钾酸性溶液反应可生成乙酸.在加热和浓硫酸作用下,乙酸与乙醇反应可生成一种有香味的物质乙酸乙酯,该反应的化学方程式为:
CH3CH2OH+CH3COOH$→_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,
46g 60g 88g
由方程式可知,乙醇过量,按乙酸计算,120g乙酸理论上产生乙酸乙酯为:$\frac{88g}{60g}×120g$=176g,故该反应产率为:$\frac{106g}{176g}×100%$=60.2%,
故答案为:60.2%.
点评 本题考查有机物的推断,侧重于学生分析能力、计算能力和实验能量的考查,注意把握常见有机物的结构和性质,题目难度中等.

| A. | C生成的速率与C分解的速率相等 | |
| B. | 单位时间内生成a mol A,同时生成2a mol B | |
| C. | 容器内各组分的总质量不再变化 | |
| D. | 混合气体的总物质的量不再变化 |
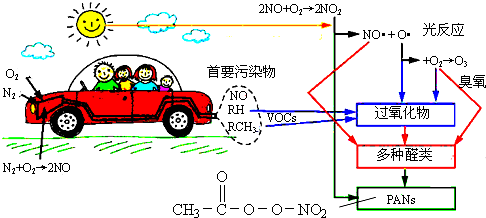
| A. | 汽车尾气中的NO、碳氢化合物(图中RH和RCH3)均来自燃油 | |
| B. | 醛类、PANs(过氧乙酰硝酸酯)均属于无机物 | |
| C. | O3污染、硝酸型酸雨及雾霾均与汽车尾气排放无关 | |
| D. | 汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因之一是N2与O2的反应速率加快 |
| A. | CaO与CO2 | B. | SiC与SiO2 | C. | NaCl与HCl | D. | Cl2与I2 |
| A. | 葡萄糖的分子式是C6H12O6 | B. | 葡萄糖属于有机高分子化合物 | ||
| C. | 葡萄糖是人体重要的能量来源 | D. | 葡萄糖能发生银镜反应 |
 三种常见短周期元素组成的化合物甲,是有机合成中的重要试剂.常温下为黄色气体,具有刺鼻恶臭味,遇水和潮气分解.标况下测定其密度为2.92g/L.浓硝酸与浓盐酸混合制王水过程中会产生少量甲气体、黄绿色气体A和水.
三种常见短周期元素组成的化合物甲,是有机合成中的重要试剂.常温下为黄色气体,具有刺鼻恶臭味,遇水和潮气分解.标况下测定其密度为2.92g/L.浓硝酸与浓盐酸混合制王水过程中会产生少量甲气体、黄绿色气体A和水.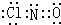 .
.