题目内容
7.2015年8月12日天津港瑞海物流危险化学品堆垛发生火灾,并发生爆炸,爆炸造成了巨大的人员伤亡及财产损失.消防员灭火时发现将水浇到化学品电石(CaC2)时引起了更剧烈的爆炸.原因是发生了反应:CaC2+2H2O═Ca(OH)2+C2H2↑,C2H2遇明火剧烈燃烧并可能爆炸.下列说法不正确的是( )| A. | 实验室保存电石时应注意密封,并置于阴凉干燥处 | |
| B. | 上述反应产生1molC2H2气体在常温常压下体积为2.24L | |
| C. | 电石与水反应不是氧化还原反应 | |
| D. | 产物C2H2属于有机物 |
分析 A.电石易与水反应生成乙炔,应密封保存,并置于阴凉干燥处;
B.标准状况下,气体摩尔体积为22.4L/mol;
C.有元素化合价发生变化的反应属于氧化还原反应;
D.有机物是含碳的化合物,有些含碳化合物性质与无机物相同一般也是无机物,如一氧化碳、二氧化碳、碳酸钙等,产物C2H2属于有机物.
解答 解:A.电石易与水反应CaC2+2H2O═Ca(OH)2+C2H2↑,生成乙炔,应密封保存,并置于阴凉干燥处,故A正确;
B.在常温常压下,1molC2H2的体积大于22.4 L,故B错误;
C.元素化合价没有发生变化,不是氧化还原反应,故C正确;
D.有机物是含碳的化合物,有些含碳化合物性质与无机物相同一般归为无机物范畴,如一氧化碳、二氧化碳、碳酸钙等,产物C2H2属于有机物,属于常见的有机物中的炔烃,故D正确;
故选B.
点评 本题考查电石的性质,侧重于物质的性质的考查,有利于培养学生良好的科学素养,难度不大,注意气体的体积与物质的状态有关,掌握物质的分类.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
18.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1molNa2O2与SO2完全反应时转移电子数为NA | |
| B. | 18g重水(D2O)所含的电子数为10NA | |
| C. | 0.5molNH4HSO4晶体中,含有H+数目约为0.5 NA | |
| D. | 常温常压下,3gHCHO和CH3COOH的混合物中含有0.4NA个原子 |
15.有两种金属组成的混合物粉末20g与足量的稀盐酸反应,生成22.4L(标准状况)H2,则该混合物的组成可能是( )
| A. | Fe 和Zn | B. | Al和Cu | C. | Na和Mg | D. | Mg和Fe |
2.单质X和单质Y反应生成X3+和Y2-,现有下列叙述:①X被氧化,②X是氧化剂,③X3+是氧化产物,④X具有氧化性,⑤Y2-是还原产物,⑥X3+具有氧化性.其中正确的是( )
| A. | ①④⑤⑥ | B. | ②③④⑤ | C. | ①③⑤⑥ | D. | ①②④⑥ |
19.利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理.某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如图.
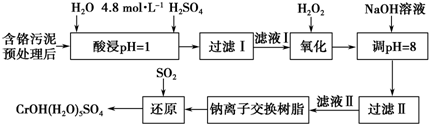
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+.
(1)实验室用98%(密度是1.84g/cm3)的浓硫酸配制250mL 4.8mol•L-1的H2SO4溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需250mL容量瓶、胶头滴管,需要取用65.2ml98%(密度是1.84g/cm3)的浓硫酸.
(2)酸浸时,为了提高浸取率可采取的措施有升高反应温度;增大固体颗粒的表面积(答出两点).
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:2Cr3++3H2O2+H2O=Cr2O72-+8H+.
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-.滤液Ⅱ中阳离子主要有Na+、Mg2+、Ca2+;但溶液的pH不能超过8,其理由是pH超过8会使部分Al(OH)3溶解生成AlO2-,最终影响Cr(III)回收与再利用.
(5)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去的滤液Ⅱ中的金属阳离子是Ca2+、Mg2+.
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:3SO2+2Na2CrO4+12H2O=2CrOH(H2O)5SO4↓+Na2SO4+2NaOH.

其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+.
(1)实验室用98%(密度是1.84g/cm3)的浓硫酸配制250mL 4.8mol•L-1的H2SO4溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需250mL容量瓶、胶头滴管,需要取用65.2ml98%(密度是1.84g/cm3)的浓硫酸.
(2)酸浸时,为了提高浸取率可采取的措施有升高反应温度;增大固体颗粒的表面积(答出两点).
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:2Cr3++3H2O2+H2O=Cr2O72-+8H+.
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | - | - | - |
| 沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
(5)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去的滤液Ⅱ中的金属阳离子是Ca2+、Mg2+.
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:3SO2+2Na2CrO4+12H2O=2CrOH(H2O)5SO4↓+Na2SO4+2NaOH.
16.一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染.已知:
①CH4(g)+4NO2 (g)═4NO(g)+CO2 (g)+2H2 O(g)△H1=-574kJ•mol-1
②CH4 (g)+4NO(g)═2N2 (g)+CO2 (g)+2H2 O(g)△H2=-1160kJ•mol-1
下列选项不正确的是( )
①CH4(g)+4NO2 (g)═4NO(g)+CO2 (g)+2H2 O(g)△H1=-574kJ•mol-1
②CH4 (g)+4NO(g)═2N2 (g)+CO2 (g)+2H2 O(g)△H2=-1160kJ•mol-1
下列选项不正确的是( )
| A. | CH4 (g)+2NO2 (g)═N2 (g)+CO2 (g)+2H2 O(g)△H=-867 kJ•mol-1 | |
| B. | CH4 (g)+4NO2 (g)═4NO(g)+CO2 (g)+2H2O(l)△H3<△H1 | |
| C. | 若用0.2 mol CH4还原NO2至N2,则反应中放出的热量一定为173.4 kJ | |
| D. | 若用标准状况下2.24 L CH4还原NO2至N2,整个过程中转移的电子为0.8mol |
 实验室常用以下方法制取氯气:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请你根据所学知识回答下列问题:
实验室常用以下方法制取氯气:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请你根据所学知识回答下列问题: