题目内容
14.海水的综合利用包括很多方面,下图是从海水中通过一系列工艺流程提取产品的流程图.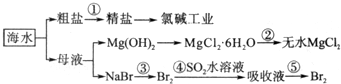
海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、SO42-、HCO3-等离子.
已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等.回答下列问题:
(1)海水pH约为8的原因主要是天然海水含上述离子中的HCO-3.
(2)除去粗盐溶液中杂质(Mg2+、SO42-、Ca2+),加入药品的顺序可以为①②④③.
①NaOH溶液②BaCl2溶液③过滤后加盐酸④Na2CO3溶液
(3)过程②中由MgCl2•6H2O制得无水MgCl2,应如何操作在HCl气流中脱水,抑制氯化镁水解,加热至恒重.
(4)从能量角度来看,氯碱工业中的电解饱和食盐水是一个将电能转化为化学能的过程.采用石墨阳极,不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式Mg+2H2O=Mg(OH)2↓+H2↑.
(5)从第③步到第④步的目的是为了浓缩富集溴.采用“空气吹出法”从浓海水中吹出Br2,并用SO2吸收.主要反应的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr.
分析 (1)海水中的弱酸根离子水解显碱性;
(2)根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,进行分析解答;
(3)氯化镁易水解,为防止水解过程③中结晶出的MgCl2•6H2O要一定条件下加热脱水制得无水MgCl2;
(4)电解饱和食盐水是电能转化为化学能,惰性电极电极熔融氯化镁生成氯气和金属镁,镁和水反应生成氢氧化镁和氢气;
(5)溴离子被氧化为溴单质后,被二氧化硫吸收生成溴离子,加入氧化剂氧化溴离子为溴单质,富集溴元素;采用“空气吹出法”从浓海水中吹出Br2,并用SO2吸收利用二氧化硫还原性和溴单质反应生成硫酸和HBr.
解答 解:(1)海水中主要含有Na+、K+、Mg2+、Cl-、SO42-、Br-、HCO-3等离子,在这些离子中能发生水解的是CO32-、HCO-3离子,HCO3-+H2O?H2CO3+OH-它们水解呈碱性,所以天然海水的pH≈8,呈弱碱性,
故答案为:HCO-3;
(2)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可溶液以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡溶液可以将硫酸根离子沉淀;至于先除镁离子,还是先除硫酸根离子都可以;钙离子用碳酸根离子沉淀,除钙离子加入过量的碳酸钠溶液转化为沉淀,但是加入碳酸钠溶液要放在加入的氯化钡溶液之后,这样碳酸钠会除去反应剩余的氯化钡;完全反应后,再进行过滤,最后再加入适量盐酸除去反应剩余的氢氧根离子和碳酸根离子,故正确的顺序为:①②④⑤,
故答案为:①②④③;
(3)镁离子水解,应抑制其水解得到无水盐,所以利用MgCl2•6H2O制得无水氯化镁,应采取的措施是在HCl气流中脱水,抑制氯化镁水解,
故答案为:在HCl气流中脱水,抑制氯化镁水解,加热至恒重;
(4)电解原理分析,电解饱和食盐水是电能转化为化学能,采用石墨阳极,不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,电解时,若有少量水存在会造成产品镁的消耗,发生反应为镁和水反应生成氢氧化镁和氢气,反应的化学方程式为:Mg+2H2O=Mg(OH)2↓+H2↑,
故答案为:电能;化学能;MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;Mg+2H2O=Mg(OH)2↓+H2↑;
(5)溴离子被氧化为溴单质后,被二氧化硫吸收生成溴离子,加入氧化剂氧化溴离子为溴单质,富集溴元素,从第③步到第⑤步的目的是为了浓缩富集溴,采用“空气吹出法”从浓海水中吹出Br2,并用SO2吸收,溴单质和二氧化硫发生氧化还原反应生成硫酸和氢溴酸,发生反应的化学方程式为:Br2+SO2+2H2O=H2SO4+2HBr,
故答案为:浓缩富集溴;Br2+SO2+2H2O=H2SO4+2HBr.
点评 本题考查了海水资源的综合利用,明确该过程中发生的反应及反应原理是解本题关键,注意除杂剂的滴加顺序、由MgCl2•6H2O制备无水MgCl2的条件,为易错点,题目难度中等.

| A. | 2,3-二甲基-4-乙基戊烷 | B. | 2-甲基-3,4-二乙基戊烷 | ||
| C. | 2,4-二甲基-3-乙基己烷 | D. | 2,3-二甲基戊烷 |
| X | |||
| Y | Z | W | A |
| T | B |
| A. | Y、Z、W、A元素性质均较为活泼,但其中Y、W在自然界中存在游离态的形式,它们的最高价氧化物的水化物的酸性依次递增 | |
| B. | X、W、Z元素的原子半径与它们的气态氢化物的热稳定性变化趋势相反 | |
| C. | 工业上电解A的钠盐溶液可以得到多种产物,为防止产物互相反应常使用阳离子交换膜,其阴极反应式为:2H2O+2e-=2OH-+H2↑ | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,T2W3具有氧化性和还原性 |
| A. | 光导纤维应避免在强碱环境中使用 | |
| B. | 船体镀锌或镀锡均可保护船体,镀层破损后将立即失去保护作用 | |
| C. | 部分卤代烃可用作灭火剂 | |
| D. | 油脂皂化生成的高级脂肪酸钠是肥皂的有效成分 |
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
则C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3 kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作洗涤剂的是AB.
A.Ca(OH)2 B.Na2CO3 C.CaCl2D.NaHSO3
(3)汽车尾气中有NOx和CO的生成:
①已知气缸中生成NO的反应为:N2(g)+O2(g)═2NO(g)△H>0
ⅰ.若1L空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6.
ⅱ.恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是D
A混合气体的密度不再变化
B混合气体的平均分子量不在变化
C N2、O2、NO的物质的量之比为1:1:2
D氧气的百分含量不在变化
ⅲ.若升高温度,则平衡正向(填“正向”或“逆向”或“不”下同)移动,逆反应速率变大(填“变大”或“变小”或“不变”).
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g).已知该反应的△H>0,则该设想能否实现不能(填“能”或“不能”).
(4)综上所述,你对该市下一步的环境建设提出的建议是燃煤脱硫;煤气化、液化后再燃烧;冬季供暖烧煤变成烧气;汽车尾气安装催化转换器.
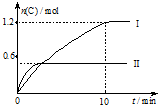 在2L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1
在2L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1实验内容和结果分别如下表和如图所示.下列说法正确的是( )
| 实验序号 | 温度 | 起始物质的量 | |
| A | B | ||
| Ⅰ | 600℃ | 1mol | 3mol |
| Ⅱ | 800℃ | 1.5mol | 0.5mol |
| A. | 实验 I中,10 min内平均反应速率v(B)=0.06 mol•L-1•min-1 | |
| B. | 上述方程式中,a<0 | |
| C. | 600℃时,该反应的平衡常数是0.45 | |
| D. | 向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 molB,A的转化率增大 |
 的有机物在一定条件下能和氢气完全加成,加成产物的一溴代物有(不考虑-OH的取代)( )
的有机物在一定条件下能和氢气完全加成,加成产物的一溴代物有(不考虑-OH的取代)( )| A. | 7种 | B. | 6种 | C. | 5种 | D. | 4种 |
| A. | 加热或点燃H2、CO、CH4等可燃性气体参与反应时,都要先检验纯度再加热或点燃. | |
| B. | 将SO2通入酸性高锰酸钾溶液中,紫红色褪去,说明SO2具有漂白性 | |
| C. | KNO3与NaCl的混合物,通过结晶法一次分离就可得到两种纯净物 | |
| D. | 检验硫酸亚铁铵溶液中Fe2+的方法是:先滴加新制氯水,后滴加KSCN溶液 |
