题目内容
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:(1)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入足量的Zn粒,产生氢气物质的量较多的是
(2)CO与H2在一定条件下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).该反应的平衡常数表达式K=
如图,在500℃、容积为3L的密闭容器中,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)某温度下Mg(OH)2 的Ksp=2×10-11.某MgSO4溶液里c(Mg2+)=0.002mol?L-1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于
(4)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色,则该溶液呈
考点:化学平衡的计算,盐类水解的应用,难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:(1)从醋酸是弱电解质的角度分析,醋酸与Zn反应同时,电离出H+,pH变化较缓慢;
(2)依据化学反应平衡常数概念结合化学方程式书写表达式,用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,平衡常数随温度变化,图象分析先拐先平,温度高,结合甲醇物质的量变化判断反应是放热反应,升温平衡逆向进行,平衡常数减小;依据图象分析甲醇物质的量变化得到浓度变化,依据速率概念计算V(CH3OH),结合反应速率之比等于化学方程式计量数之比得到氢气的反应速率;
(3)根据c(OH-)=
计算氢氧根离子浓度,从而确定溶液的pH,根据混合溶液中氢氧根离子浓度的平方与镁离子浓度的积与ksp比较,可判断;
(4)酚酞遇碱变红色,可知纯碱溶液呈碱性;向红色溶液中加入足量BaCl2溶液(或加热碳酸钠溶液),根据颜色的变化分析.
(2)依据化学反应平衡常数概念结合化学方程式书写表达式,用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,平衡常数随温度变化,图象分析先拐先平,温度高,结合甲醇物质的量变化判断反应是放热反应,升温平衡逆向进行,平衡常数减小;依据图象分析甲醇物质的量变化得到浓度变化,依据速率概念计算V(CH3OH),结合反应速率之比等于化学方程式计量数之比得到氢气的反应速率;
(3)根据c(OH-)=
|
(4)酚酞遇碱变红色,可知纯碱溶液呈碱性;向红色溶液中加入足量BaCl2溶液(或加热碳酸钠溶液),根据颜色的变化分析.
解答:
解:(1)由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以B曲线是醋酸溶液的pH变化曲线,故答案为:醋酸;
(2)CO(g)+2H2(g)?CH3OH(g),反应达到平衡时,平衡常数表达式K=
;图象分析可知先拐先平温度高,T2>T1,温度越高甲醇物质的量越小,说明升温平衡逆向进行,逆向是吸热反应,正反应是放热反应,升温平衡逆向进行,平衡常数减小;
在图象中,T2时,从反应开始到平衡甲醇生成物质的量nB,V(H2)=2V(CH3OH)=2×
=
mol/(L?min);
故答案为:
;减小;
mol/(L?min);
(3)0.002mol?L-1MgSO4溶液中c(Mg2+)=0.0002mol/L,沉淀平衡时c(OH-)=
=
mol/L=10-4 mol/L,则c(H+)=10-10 mol/L,所以溶液的pH=-lgc(H+)=10,故应调整溶液pH大于10,往0.0001mol?L-1 MgSO4溶液中加入等体积的0.10mol?L-1的氨水,镁离子的浓度为5×10-5mol?L-1,氢氧根的浓度为0.05×1%=5×10-4mol?L-1,c(Mg2+)?c2(OH-)=2.5×10-8<Ksp=2×10-11,无沉淀产生,
故答案为:10;无;
(4)酚酞遇碱变红色,该溶液呈红色说明是碱性溶液,要验证该溶液遇酚酞呈红色原因,可用以下方法,
方法一:向红色溶液中加入足量BaCl2溶液,如果红色褪去,则说明是CO32-发生水解所致;
方法二:加热,如果红色加深,则说明是CO32-发生水解所致,
故答案为:碱;向红色溶液中加入足量BaCl2溶液,如果红色褪去,则说明是CO32-水解所致.
(2)CO(g)+2H2(g)?CH3OH(g),反应达到平衡时,平衡常数表达式K=
| c(CH3OH) |
| c(CO)c2(H2) |
在图象中,T2时,从反应开始到平衡甲醇生成物质的量nB,V(H2)=2V(CH3OH)=2×
| ||
| tBmin |
| 2nB |
| 3tB |
故答案为:
| c(CH3OH) |
| c(CO)c2(H2) |
| 2nB |
| 3tB |
(3)0.002mol?L-1MgSO4溶液中c(Mg2+)=0.0002mol/L,沉淀平衡时c(OH-)=
|
|
故答案为:10;无;
(4)酚酞遇碱变红色,该溶液呈红色说明是碱性溶液,要验证该溶液遇酚酞呈红色原因,可用以下方法,
方法一:向红色溶液中加入足量BaCl2溶液,如果红色褪去,则说明是CO32-发生水解所致;
方法二:加热,如果红色加深,则说明是CO32-发生水解所致,
故答案为:碱;向红色溶液中加入足量BaCl2溶液,如果红色褪去,则说明是CO32-水解所致.
点评:本题考查了弱电解质的电离、化学平衡常数、化学反应速率概念的理解应用、溶度积有关计算、盐类水解等知识点,是高考的热点,应熟练掌握,难度中等.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A、在标准状况下,2.24 L HF含有的电子数为NA |
| B、7.8 g Na2S和Na2O2的混合物中所含离子数为0.3NA |
| C、常温下,2.7 g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA |
| D、电解精炼铜时,阳极质量每减少32 g,电路中就转移NA个电子 |
将一定量的氯气通入50mL浓度为12.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系.下列判断正确的是( )
| A、与NaOH反应的氯气一定为0.25 mol |
| B、n(Na+):n(Cl-)可能为7:3 |
| C、若反应中转移的电子为n mol,则0.30<n<0.45 |
| D、n(NaCl):n(NaClO):n(NaClO3)可能为11:1:2 |
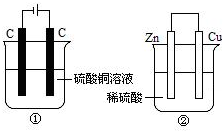 如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )| A、产生气体体积 ①=② |
| B、①中阴极质量增加,②中正极质量减小 |
| C、溶液的pH变化:①减小,②增大 |
| D、电极反应式:①中阳极:4OH--4e-=2H2O+O2↑②中负极:2H++2e-=H2↑ |

 用如图装置做如下实验.其中收集方法及所加试剂、现象、结论均正确的是
用如图装置做如下实验.其中收集方法及所加试剂、现象、结论均正确的是
 将1.66g碳酸钠和氢氧化钠的固体混合物完全溶于水,配成稀溶液,然后向该溶液中逐滴加入1mo1?L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示.
将1.66g碳酸钠和氢氧化钠的固体混合物完全溶于水,配成稀溶液,然后向该溶液中逐滴加入1mo1?L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示.