题目内容
16.下列物质不属于离子化合物是( )| A. | Na2O2 | B. | KOH | C. | NH4Cl | D. | HCl |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,共价化合物中一定不含离子键,据此分析解答.
解答 解:A.过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在共价键,为离子化合物,故A错误;
B.KOH中钾离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键,为离子化合物,故B错误;
C.氯化铵中铵根离子和氯离子之间存在离子键、N-H原子之间存在共价键,为离子化合物,故C错误;
D.HCl中只含共价键,为共价化合物,故D正确;
故选D.
点评 本题考查了化学键和化合物的关系,明确离子化合物和共价化合物的内涵是解本题关键,根据化合物中存在的化学键判断,注意不能根据元素来确定化合物类型,如铵盐全部由非金属元素组成,但为离子化合物,氯化铝由金属元素组成,但为共价化合物,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有跟氖原子相同的电子层结构,则正确的是( )
| A. | 原子半径 A>B>D>C | |
| B. | 原子序数 d>c>b>a | |
| C. | 离子半径 C3->D->B+>A2+ | |
| D. | 原子结构的最外层电子数目 A>B>D>C |
4.向一定量的FeO、Fe、Fe3O4的混合物中加入100mL 1mol•L-1的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,在所得溶液中经检验无Fe3+.若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是( )
| A. | 11.2g | B. | 5.6g | C. | 2.8g | D. | 无法计算 |
11.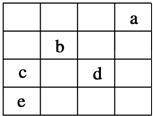 如图中,a、b、c、d、e为元素周期表中前四周期的一部分元素,下列有关叙述正确的是( )
如图中,a、b、c、d、e为元素周期表中前四周期的一部分元素,下列有关叙述正确的是( )
 如图中,a、b、c、d、e为元素周期表中前四周期的一部分元素,下列有关叙述正确的是( )
如图中,a、b、c、d、e为元素周期表中前四周期的一部分元素,下列有关叙述正确的是( )| A. | 元素c和d的最高价氧化物对应水化物的酸性:c>d | |
| B. | 五种元素中,元素e的性质最稳定 | |
| C. | 元素b位于ⅥA族,有+6、-2两种常见化合价 | |
| D. | 元素c和e的气态氢化物的稳定性:c>e |
1.下列关于多电子原子的核外电子运动规律的叙述正确的是( )
①核外电子是分层运动的 ②所有电子在同一区域里运动 ③能量高的电子在离核近的区域里运动 ④能量低的电子在离核近的区域里运动.
①核外电子是分层运动的 ②所有电子在同一区域里运动 ③能量高的电子在离核近的区域里运动 ④能量低的电子在离核近的区域里运动.
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
8.油脂的硬化属于( )
| A. | 氧化反应 | B. | 加成反应 | C. | 取代反应 | D. | 化合反应 |
5.A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3:4,D能分别与A、B、C形成电子数均为10的分子X、Y、Z.下列叙述错误的是( )
| A. | A、B、C、D能形成5种以上单质 | |
| B. | D能分别与A、B、C反应越来越难 | |
| C. | X、Y、Z的稳定性逐渐增强 | |
| D. | B的气态氢化物能与其最高价含氧酸反应 |