题目内容
15.某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42-、SiO32-、NO3-中的一种或几种离子,取该溶液进行实验,其现象及转化如图.反应过程中有一种气体是红棕色.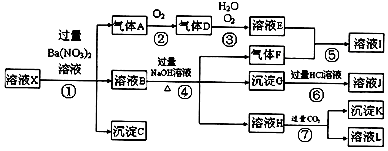
请回答下列问题:
(1)产生气体A的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO+2H2O;
(2)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为1:4;
(3)转化⑦中的离子方程式为2H2O+AlO2-+CO2=Al(OH)3+HCO3-;
(4)溶液X中,关于NO3-的判断一定正确的是b.
a.一定有 b.一定没有 c.可能有.
分析 某强酸性溶液X,则溶液中不存在弱酸根离子CO32-、SiO32-,溶液和硝酸钡溶液反应生成沉淀C,则溶液存在SO42-,不存在和硫酸根离子反应的Ba2+,C是BaSO4;
酸性条件下硝酸根离子具有强氧化性,所以溶液中Fe2+和NO3-不能共存,加入硝酸钡产生气体,则溶液中存在Fe2+,不存在NO3-,气体A是NO,由反应②可知生成D为NO2,③中生成E为硝酸;
溶液B中加入过量氢氧化钠溶液时,产生气体F,则溶液中含有NH4+,F是NH3,产生沉淀,由于溶液中存在Fe2+,沉淀G是Fe(OH)3,溶液H中通入过量二氧化碳生成沉淀,则溶液中存在Al3+,溶液H中含有偏铝酸根,沉淀K是Al(OH)3,溶液L是NaHCO3,以此来解答.
解答 解:(1)A为NO,产生气体A的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO+2H2O,故答案为:3Fe2++NO3-+4H+=3Fe3++NO+2H2O;
(2)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,发生4NO2+O2+4H2O=4HNO3,则反应中O2与D的物质的量之比为1:4,故答案为:1:4;(3)转化⑦中的离子方程式为2H2O+AlO2-+CO2=Al(OH)3+HCO3-,故答案为:2H2O+AlO2-+CO2=Al(OH)3+HCO3-;
(4)溶液中Fe2+和NO3-不能共存,加入硝酸钡产生气体,则溶液中存在Fe2+,不存在NO3-,只有b符合,故答案为:b.
点评 本题考查常见离子的检验,为高频考点,把握离子的性质、发生的反应为解答的关键,侧重分析与实验能力的考查,注意发生的氧化还原反应,题目难度不大.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案
相关题目
6.下列实验能达到预期目的是( )
| A. | 向淀粉溶液中加入稀硫酸加热后,再用NaOH中和,并做银镜反应实验--检验淀粉是否水解 | |
| B. | 向甲酸和甲醛的混合物中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热:检验混合物中是否含有甲醛 | |
| C. | 向米汤中加入含碘的食盐,观察是否有颜色的变化--检验含碘食盐中是否含碘酸钾 | |
| D. | 检验某溴乙烷中的溴元素可向其中加入AgNO3溶液,观察有无浅黄色沉淀 |
3.下列从海洋中获取物质的方案不合理的是( )
| A. | 粗盐先通过除杂、精制得到饱和食盐水,然后电解得到氯气,最后和石灰乳反应制得漂白粉 | |
| B. | 苦卤酸化后通入氯气得到溴水,然后用热空气将其通入到SO2水溶液中,最后通入氯气后蒸馏得粗溴 | |
| C. | 干海带灼烧后加水浸取,然后加入H2O2得到碘水,最后通过萃取、分液、蒸馏得到碘单质 | |
| D. | 向海水中加入石灰乳得到Mg(OH)2,加入盐酸得到MgCl2溶液,最后电解该溶液得到镁单质 |
10.孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物.以孔雀石为原料可制备CuCl2•3H2O及纯碱,流程如图所示.

已知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH如表所示.回答下列问题.
(1)图中“试剂1”为Cl2(或H2O2).
(2)加入CuO的作用是调节溶液pH,则pH的范围为3.2≤pH<4.7.
(3)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通入饱和食盐水中.其中,应先通入的气体是F、NH3(填代号及对应物质的化学式).
(4)由溶液C获得CuCl2•3H2O,需要经过蒸发浓缩、冷却结晶、过滤等操作.

已知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH如表所示.回答下列问题.
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物安全沉淀 | 3.2 | 9.0 | 6.7 | |
(2)加入CuO的作用是调节溶液pH,则pH的范围为3.2≤pH<4.7.
(3)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通入饱和食盐水中.其中,应先通入的气体是F、NH3(填代号及对应物质的化学式).
(4)由溶液C获得CuCl2•3H2O,需要经过蒸发浓缩、冷却结晶、过滤等操作.
 图为元素X的前五级电离能的数值示意图.已知X的原子序数小于20,请写出X基态原子核外电子的轨道表示式
图为元素X的前五级电离能的数值示意图.已知X的原子序数小于20,请写出X基态原子核外电子的轨道表示式 .
. ⑨乙醇 ⑩固体氯化钠
⑨乙醇 ⑩固体氯化钠