题目内容
现有五种1~20号元素组成A~I纯净物(试剂X除外),转化关系如图:
相关信息有:
(a)反应④产生白色沉淀,且M(H)=143.5g/mol.
(b)常温下,A、I都是气态单质,且I的一种同素异形体和A都能使湿润的有色布条褪色且都能用于饮用水消毒.
(c) B为强碱,1molB含28mole-,反应③属于分解反应,为实验室制取I气体的原理.
(d)C是由第三周期的两种元素组成原子个数比为1:3型化合物.
(1)B的电子式为 .试剂X的名称为 .反应②离子方程式: .
(2)写出反应③的化学方程式: .
(3)C溶液中阴离子浓度与阳离子浓度之比 3(填:大于、小于或等于);简述实验室用C晶体配制3.0mol/L的C溶液的操作方法是 .
(4)写出G与C溶液混合的离子方程式: .

相关信息有:
(a)反应④产生白色沉淀,且M(H)=143.5g/mol.
(b)常温下,A、I都是气态单质,且I的一种同素异形体和A都能使湿润的有色布条褪色且都能用于饮用水消毒.
(c) B为强碱,1molB含28mole-,反应③属于分解反应,为实验室制取I气体的原理.
(d)C是由第三周期的两种元素组成原子个数比为1:3型化合物.
(1)B的电子式为
(2)写出反应③的化学方程式:
(3)C溶液中阴离子浓度与阳离子浓度之比
(4)写出G与C溶液混合的离子方程式:
考点:无机物的推断
专题:
分析:反应④产生白色沉淀,且M(H)为143.5g/mol,可知H为AgCl,故D含有Cl-,试剂X为硝酸银溶液;常温下,A、I都是气态单质,A的水溶液具有漂白性,则A为Cl2,I的一种同素异形体和A都能使湿润的有色布条褪色且都能用于饮用水消毒,所以I为O2,它的同互异形体为O3,反应③属于分解反应生成氧气与D,为实验室制取I气体的原理,反应生成的D含有Cl-,故E为KClO3,D为KCl,B为强碱,反应①Cl2+B→KCl+KClO3+F,氯气发生歧化反应,考虑氯气与碱的反应,B含有K元素,1molB含28mole-,故B为KOH,F为H2O;由反应②KOH+C→H2O+G+KCl,故C含有Cl元素,C是由第三周期的两种元素组成原子个数比为1:3型化合物,故C为AlCl3,G为KAlO2,据此答题.
解答:
解:反应④产生白色沉淀,且M(H)为143.5g/mol,可知H为AgCl,故D含有Cl-,试剂X为硝酸银溶液;常温下,A、I都是气态单质,A的水溶液具有漂白性,则A为Cl2,I的一种同素异形体和A都能使湿润的有色布条褪色且都能用于饮用水消毒,所以I为O2,它的同互异形体为O3,反应③属于分解反应生成氧气与D,为实验室制取I气体的原理,反应生成的D含有Cl-,故E为KClO3,D为KCl,B为强碱,反应①Cl2+B→KCl+KClO3+F,氯气发生歧化反应,考虑氯气与碱的反应,B含有K元素,1molB含28mole-,故B为KOH,F为H2O;由反应②KOH+C→H2O+G+KCl,故C含有Cl元素,C是由第三周期的两种元素组成原子个数比为1:3型化合物,故C为AlCl3,G为KAlO2,
(1)由上述分析可知,B为KOH,电子式为 ,试剂X为硝酸银溶液;反应②是过量氢氧化钾与氯化铝反应生成氯化钾、偏铝酸钾、水,反应离子方程式为:4OH-+Al3+=AlO2-+2H2O,
,试剂X为硝酸银溶液;反应②是过量氢氧化钾与氯化铝反应生成氯化钾、偏铝酸钾、水,反应离子方程式为:4OH-+Al3+=AlO2-+2H2O,
故答案为: ;硝酸银溶液;4OH-+Al3+=AlO2-+2H2O;
;硝酸银溶液;4OH-+Al3+=AlO2-+2H2O;
(2)反应③的反应方程式为:2KClO3
2KCl+3O2↑;
故答案为:2KClO3
2KCl+3O2↑;
(3)C为AlCl3,AlCl3溶液中Al3+离子水解,产生氢离子,一个铝离子水解能产生3个氢离子,所以溶液中阴离子浓度与阳离子浓度之比小于3,实验室用AlCl3晶体配制3.0mol/L的AlCl3溶液的操作方法是称取一定量的氯化铝晶体倒入烧杯中,加入一定量的盐酸溶解,在一定体积的容量瓶中配制3mol/L氯化铝溶液,
故答案为:小于;称取一定量的氯化铝晶体倒入烧杯中,加入一定量的盐酸溶解,在一定体积的容量瓶中配制3mol/L氯化铝溶液;
(4)C为AlCl3,G为KAlO2,G与C溶液混合的离子方程式为3AlO2-+Al3++6H2O=4Al(OH)3↓,
故答案为:3AlO2-+Al3++6H2O=4Al(OH)3↓.
(1)由上述分析可知,B为KOH,电子式为
 ,试剂X为硝酸银溶液;反应②是过量氢氧化钾与氯化铝反应生成氯化钾、偏铝酸钾、水,反应离子方程式为:4OH-+Al3+=AlO2-+2H2O,
,试剂X为硝酸银溶液;反应②是过量氢氧化钾与氯化铝反应生成氯化钾、偏铝酸钾、水,反应离子方程式为:4OH-+Al3+=AlO2-+2H2O,故答案为:
 ;硝酸银溶液;4OH-+Al3+=AlO2-+2H2O;
;硝酸银溶液;4OH-+Al3+=AlO2-+2H2O;(2)反应③的反应方程式为:2KClO3
| ||
| △ |
故答案为:2KClO3
| ||
| △ |
(3)C为AlCl3,AlCl3溶液中Al3+离子水解,产生氢离子,一个铝离子水解能产生3个氢离子,所以溶液中阴离子浓度与阳离子浓度之比小于3,实验室用AlCl3晶体配制3.0mol/L的AlCl3溶液的操作方法是称取一定量的氯化铝晶体倒入烧杯中,加入一定量的盐酸溶解,在一定体积的容量瓶中配制3mol/L氯化铝溶液,
故答案为:小于;称取一定量的氯化铝晶体倒入烧杯中,加入一定量的盐酸溶解,在一定体积的容量瓶中配制3mol/L氯化铝溶液;
(4)C为AlCl3,G为KAlO2,G与C溶液混合的离子方程式为3AlO2-+Al3++6H2O=4Al(OH)3↓,
故答案为:3AlO2-+Al3++6H2O=4Al(OH)3↓.
点评:本题以无机框图推断题的形式,考查Al、Cl等元素单质及其化合物之间的相互转化,A、I的状态与性质用途、H的颜色与摩尔质量等均为解题突破口,结合转化关系运用顺推法与逆推法进行推断,对学生的逻辑推理有较高要求.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
只用水就能鉴别的一组物质是( )
| A、苯,己烷,四氯化碳 |
| B、乙醇,乙醛,乙酸 |
| C、乙醇,硝基苯,乙酸乙酯 |
| D、己烷,乙醇,甲醇 |
下列物质与水反应生成强酸的是( )
| A、Na2O |
| B、NO2 |
| C、SO2 |
| D、SO3 |
下列反应不属于消去反应的是( )
A、CH3CH2OH
| |||
B、CH3CHBrCH3+NaOH
| |||
C、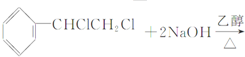  | |||
D、2CH3OH
|
 氮氧化物和SO2是造成雾霾天气的主要原因之一.
氮氧化物和SO2是造成雾霾天气的主要原因之一. 铃兰醛具有甜润的香味,常用作肥料、洗涤剂和化妆品的香料.合成铃兰醛的路线如图所示(部分试剂和条件未注明):
铃兰醛具有甜润的香味,常用作肥料、洗涤剂和化妆品的香料.合成铃兰醛的路线如图所示(部分试剂和条件未注明):
