题目内容
2.食品安全国家标准(GB2760-2014)规定葡萄酒中SO2最大使用量为0.25g/L.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对SO2性质进行探究.Ⅰ.(1)仪器A的名称是冷凝管;
(2)仪器B中加入300mL葡萄酒和适量盐酸,加热使SO2全部逸出,并与C中H2O2完全反应,C中化学反应方程式为SO2+H2O2=H2SO4;
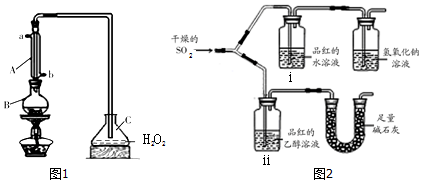
Ⅱ.小组同学为探究SO2的漂白性和还原性,设计了如下实验.
a漂白性 用如图2所示装置(气密性良好)进行实验,观察到如下现象:ⅰ中红色褪去、ⅱ中无变化.
(3)足量碱石灰的作用是防止空气中的水蒸气进入ⅱ中干扰实验,吸收二氧化硫防污染;
(4)从实验中可知使品红的水溶液褪色的微粒可能是H2SO3、HSO3-、SO32-;
b还原性 将SO2通入FeCl3溶液中,使其充分反应.
(5)SO2与FeCl3反应的离子方程式是2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,如何检验该反应所得含氧酸根离子取少量反应混合液,加入盐酸酸化后加氯化钡溶液,产生白色沉淀,混合液中即含有SO42-
(6)实验中观察到溶液由黄色变为红棕色,静置一段时间,变为浅绿色.
已知:红棕色为FeSO3(墨绿色难溶物)与FeCl3溶液形成的混合色;Fe3+可氧化SO32-;则②中红棕色变为浅绿色的原因是混合液中存在平衡FeSO3(s)?Fe2+(aq)+SO32-(aq),Fe3+会与SO32-发生氧化还原反应,使平衡右移,墨绿色沉淀溶解,最终生成浅绿色FeSO4溶液.
分析 (1)由装置可知仪器A为冷凝管;
(2)仪器B中加入300mL葡萄酒和适量盐酸,加热使SO2全部逸出,并与C中H2O2完全反应,酸性条件下二氧化硫被过氧化氢氧化生成硫酸;
(3)实验目的是验证干燥的二氧化硫能否漂白品红,应避免空气中水蒸气加入,SO2对环境有污染,需要尾气处理;
(4)SO2不能使品红的乙醇溶液褪色,而其水溶液可以,使品红褪色的微粒含有S元素;
(5)铁离子具有强氧化性,在溶液中可以将二氧化硫氧化为硫酸根;利用盐酸酸化的氯化钡溶液检验硫酸根离子;
(6)混合液中存在平衡FeSO3(s)?Fe2+(aq)+SO32-(aq),Fe3+会与SO32-发生氧化还原反应,使平衡右移,最终生成FeSO4溶液.
解答 解:(1)由装置可知仪器A为冷凝管,用于冷凝回流,故答案为:冷凝管;
(2)仪器B中加入300mL葡萄酒和适量盐酸,加热使SO2全部逸出,并与C中H2O2完全反应,酸性条件下二氧化硫被过氧化氢氧化生成硫酸,反应的化学方程式为:SO2+H2O2=H2SO4,
故答案为:SO2+H2O2=H2SO4;
(3)实验目的是验证干燥的二氧化硫能否漂白品红,应避免空气中水蒸气加入,SO2对环境有污染,需要吸收处理,故碱石灰的作用是防止空气中的水蒸气进入ⅱ中干扰实验,吸收二氧化硫防污染,
故答案为:防止空气中的水蒸气进入ⅱ中干扰实验,吸收二氧化硫防污染;
(4)SO2不能使品红褪色,而其水溶液可以,因此使品红褪色的微粒可能是H2SO3、HSO3-、SO32-,故答案为:H2SO3、HSO3-、SO32-;
(5)SO2与FeCl3反应的离子方程式是:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,检验SO42-的方法是:取少量反应混合液,加入盐酸酸化后加氯化钡溶液,产生白色沉淀,混合液中即含有SO42-,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;取少量反应混合液,加入盐酸酸化后加氯化钡溶液,产生白色沉淀,混合液中即含有SO42-;
(6)混合液中存在平衡FeSO3(s)?Fe2+(aq)+SO32-(aq),Fe3+会与SO32-发生氧化还原反应,使平衡右移,墨绿色沉淀溶解,最终生成浅绿色FeSO4溶液,
故答案为:混合液中存在平衡FeSO3(s)?Fe2+(aq)+SO32-(aq),Fe3+会与SO32-发生氧化还原反应,使平衡右移,墨绿色沉淀溶解,最终生成浅绿色FeSO4溶液.
点评 本题考查物质的性质实验设计,为高频考点,把握实验装置的作用、物质的性质及发生的反应、实验技能为解答的关键,侧重分析与实验能力的考查,注意氧化还原反应及平衡移动原理的应用,题目难度不大.

| A. | 在标准状况下,22.4LCCl4中含5 NA个原子 | |
| B. | 0.1mol铁与足量的盐酸完全反应,铁失去的电子数为0.1 NA | |
| C. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1 NA | |
| D. | 将100mL0.1mol•L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目为0.01 NA |
 一定条件下存在反应C(s)+H2O(g)?C O(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示.则下列说法正确的是( )
一定条件下存在反应C(s)+H2O(g)?C O(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示.则下列说法正确的是( )| 容 器 | 甲 | 乙 | 丙 |
| 容 积 | 0.5L | 0.5L | V |
| 温 度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2molC 1molH2O | 1molCO 1molH2 | 4molC 2molH2O |
| A. | 甲容器中,反应在前15min的平均速率v(H2)=0.2mol•L-1•min-1 | |
| B. | 丙容器的体积V>0.5L | |
| C. | 当温度为T1℃时,反应的平衡常数K=4.5(mol•L-1) | |
| D. | 乙容器中,若平衡时n(H2O)=0.4mol,则T1<T2 |
| A. | 容器Ⅰ、Ⅱ中正反应速率相同 | |
| B. | 容器Ⅰ中的气体颜色比容器Ⅱ中的气体颜色深 | |
| C. | 容器Ⅰ、Ⅲ中反应的平衡常数相同 | |
| D. | 容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化率之和等于1 |

(1)一种常用的方法是在230℃、有催化剂条件下将CO2和H2转化为甲醇蒸汽和水蒸气.图2是生成1mol CH3OH时的能量变化示意图.
已知破坏1mol不同共价键的能量(kJ)分别是:
| C-H | C-O | C=O | H-H | H-O |
| 413.4 | 351 | 745 | 436 | 462.8 |
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行如下反应:
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验 | 温度/℃ | 起始量 | 达到平衡 | |||
| CO/mol | H2O/mol | H2/mol | CO转化率 | 所需时间/min | ||
| 1 | 650 | 4 | 2 | 1.6 | 6 | |
| 2 | 900 | 2 | 1 | $\frac{1}{3}$ | 3 | |
| 3 | 900 | a | b | c | t | |
②实验2条件下的平衡常数K=1.
③实验3中,若平衡时H2O的转化率为$\frac{1}{3}$,则a/b=0.5.
④实验4,若900℃时,在容器中加入CO、H2O、CO2、H2各1mol,则此时反应达到平衡状态
(填“向正反应方向进行”,“向逆反应方向进行”,“达到平衡状态”).
(3)捕捉CO2可以利用Na2CO3溶液.先用Na2CO3溶液吸收CO2生成NaHCO3,然后使NaHCO3分解,Na2CO3可以进行循环使用.将100mL 0.1mol/LNa2CO3的溶液中通入112mL(已换算为标准状况)的CO2,溶液中没有晶体析出,则:
①反应后溶液中的各离子浓度由大到小的顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
②反应后的溶液可以作“缓冲液”(当往溶液中加入一定量的酸和碱时,有阻碍溶液pH变化的作用),请解释其原理反应后的溶液存在HCO3-?CO32-+H+,加入少量的酸,平衡逆向移动,溶液pH变化不大;加入少量的碱平衡正向移动,溶液pH变化也不大,故该溶液可以作“缓冲液”.
| A. | Na2S水解:S2-+2 H2O?H2S+2OH- | |
| B. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| C. | 向次氯酸钙溶液通入过量CO2:Ca2++2CIO-+H2O+CO2═CaCO3↓+2HClO | |
| D. | 向次氯酸钙溶液通入SO2:Ca2++2CIO-+H2O+SO2═CaSO3↓+2HClO |
①氢氧化钠的表面发生潮解
②充有氢气的气球遇明火爆炸
③铁制菜刀生锈
④铜铸塑像上出现铜绿[Cu2(OH)2CO3]
⑤维生素C帮助人体将食物中摄取的不易吸收的Fe3+转变为易吸收的Fe2+
⑥浓硫酸久置体积变大⑦澄清石灰水变浑浊.
| A. | ①②③④ | B. | ②③④⑤ | C. | ③④⑤⑥ | D. | ④⑤⑥⑦ |
| A. | 中和反应时并不一定都伴随着能量变化 | |
| B. | 所有的燃烧反应都是放热反应 | |
| C. | 只要有能量变化的都是化学变化 | |
| D. | 任何反应中的能量变化都表现为热量变化 |