题目内容
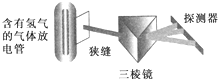 在实验室中用下列的装置可以得到氢原子光谱,实验证明该光谱为线状光谱,该光谱的发现在原子结构的认识过程中,有极为重要的意义,根据它产生了( )
在实验室中用下列的装置可以得到氢原子光谱,实验证明该光谱为线状光谱,该光谱的发现在原子结构的认识过程中,有极为重要的意义,根据它产生了( )| A、卢瑟福核式原子模型 |
| B、汤姆逊“葡萄干布丁”模型 |
| C、玻尔核外电子分层排布模型 |
| D、原子结构的量子力学模型 |
考点:原子构成
专题:原子组成与结构专题
分析:A.卢瑟福提出原子的核式结构模型,这一模型建立的基础是α粒子散射实验;
B.汤姆孙根据实验发现了电子,而且原子呈电中性,据此提出原子的葡萄干面包模型;
C.玻尔的原子模型中电子轨道和原子的能量都是量子化的,是建立在三个基本假设的基础上的理论;
D.奥地利物理学家薛定谔提出电子云模型(几率说),为近代量子力学原子模型.
B.汤姆孙根据实验发现了电子,而且原子呈电中性,据此提出原子的葡萄干面包模型;
C.玻尔的原子模型中电子轨道和原子的能量都是量子化的,是建立在三个基本假设的基础上的理论;
D.奥地利物理学家薛定谔提出电子云模型(几率说),为近代量子力学原子模型.
解答:
解:A.卢瑟福根据对α粒子散射实验结果的研究,提出原子的核式结构模型,故A错误;
B.1897年,英国科学家汤姆生发现了电子,1904年提出“葡萄干面包式”的原子结构模型,故B错误;
C.1913年丹麦物理学家波尔(卢瑟福的学生)引入量子论观点,提出电子在一定轨道上运动的原子结构模型,原子系统只能具有一系列的不连续的能量状态,当原子从一个具有较大能量的定态跃迁到另一个能量较低的定态时,它辐射出具有一定频率的光子,原子的不同能量状态和电子沿不同的圆形轨道绕核运动相对应,氢原子光谱指的是氢原子内的电子在不同能阶跃迁时所发射或吸收不同波长,该光谱的发现在玻尔核外电子分层排布模型原子结构的认识过程中,有极为重要的意义,故C正确;
D.原子结构的量子力学模型在处理核外电子量子化特性及波粒二象性提供主要论据和重要结论,故D错误;
故选C.
B.1897年,英国科学家汤姆生发现了电子,1904年提出“葡萄干面包式”的原子结构模型,故B错误;
C.1913年丹麦物理学家波尔(卢瑟福的学生)引入量子论观点,提出电子在一定轨道上运动的原子结构模型,原子系统只能具有一系列的不连续的能量状态,当原子从一个具有较大能量的定态跃迁到另一个能量较低的定态时,它辐射出具有一定频率的光子,原子的不同能量状态和电子沿不同的圆形轨道绕核运动相对应,氢原子光谱指的是氢原子内的电子在不同能阶跃迁时所发射或吸收不同波长,该光谱的发现在玻尔核外电子分层排布模型原子结构的认识过程中,有极为重要的意义,故C正确;
D.原子结构的量子力学模型在处理核外电子量子化特性及波粒二象性提供主要论据和重要结论,故D错误;
故选C.
点评:本题考查了原子的结构和化学史,题目难度不大,注意基础知识的积累.注意玻尔原子模型:电子的轨道量子化,原子的能量量子化.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列实验操作正确的是( )
| A、过滤时,倾倒液体用玻璃棒引流 |
| B、用剩的药品放回原瓶 |
| C、用细口瓶盛放固体药品 |
| D、用托盘天平称量药品时,左盘放砝码,右盘放药品 |
将pH=3的硫酸溶液和pH=10的氢氧化钠溶液相混合,若要使混合后溶液的pH=7,则硫酸溶液和氢氧化溶液的体积比约为( )
| A、1:2 | B、1:9 |
| C、1:10 | D、1:20 |
如图是一种燃料型电池检测仪的工作原理示意图.下列说法不正确的是( )


| A、该仪器工作时酒精浓度越大,则电流强度越大 |
| B、工作时处电路电子流向为X→Y |
| C、检测结束后,X极区的pH增大 |
| D、电池总反应为2CH3CH2OH+O2═2CH3CHO+2H2O |
下列反应,属于复分解反应的是( )
| A、CaCO3═CaO+CO2↑ |
| B、2HClO═2HCl+O2↑ |
| C、NaOH+HCl═NaCl+H2O |
| D、Fe+CuSO4═FeSO4+Cu |
 某反应过程中的能量变化如图所示:
某反应过程中的能量变化如图所示: