题目内容
现有以下物质:①Al ②稀硫酸 ③NaHCO3 ④液氨 ⑤盐酸 ⑥蔗糖溶液 ⑦无水乙醇 ⑧熔融NaOH
⑨NaHSO4 ⑩CO2,回答下列问题(用相应物质的序号填写)
(1)可以导电的有
(2)属于非电解质的有
(3)请写出③的电离方程式
(4)写出⑧中的物质的溶液与⑨的溶液反应的离子方程式
(5)写出①与⑧中的物质的溶液反应的离子方程式 .
⑨NaHSO4 ⑩CO2,回答下列问题(用相应物质的序号填写)
(1)可以导电的有
(2)属于非电解质的有
(3)请写出③的电离方程式
(4)写出⑧中的物质的溶液与⑨的溶液反应的离子方程式
(5)写出①与⑧中的物质的溶液反应的离子方程式
考点:电解质与非电解质,电离方程式的书写,电解质溶液的导电性
专题:电离平衡与溶液的pH专题
分析:(1)电解质是在熔融状态或水溶液中能导电的化合物,电解质在熔融状态下或水溶液中能导电,金属单质和半导体材料能导电;
(2)非电解质是在熔融状态和水溶液中都不导电的化合物;
(3)NaHCO3是盐,在水溶液中完全电离;
(4)NaOH 与NaHSO4 反应生成硫酸钠和水;
(5)Al与氢氧化钠溶液反应生成偏铝酸钠和氢气.
(2)非电解质是在熔融状态和水溶液中都不导电的化合物;
(3)NaHCO3是盐,在水溶液中完全电离;
(4)NaOH 与NaHSO4 反应生成硫酸钠和水;
(5)Al与氢氧化钠溶液反应生成偏铝酸钠和氢气.
解答:
解:(1)物质能导电必须存在能自由移动的带电微粒.电解质在熔融状态下或水溶液中能导电,金属单质和石墨等存在自由电子能导电,①②⑤⑧能导电,
故答案为:①②⑤⑧;
(2)非电解质是在熔融状态和水溶液中都不导电的化合物,④液氨属于非电解质; ⑥蔗糖溶液是混合物不是非电解质 ⑦无水乙醇是非电解质 ⑩CO2是非电解质,
故答案为:④⑦⑩;
(3)NaHCO3是盐,在水溶液中完全电离出Na+和HCO3-,电离方程式为:NaHCO3═Na++HCO3-,故答案为:NaHCO3═Na++HCO3-;
(4)NaOH 与NaHSO4 反应生成硫酸钠和水,其反应的离子方程式为:OH-+H+═H2O,故答案为:OH-+H+═H2O;
(5)Al与氢氧化钠溶液反应生成偏铝酸钠和氢气,其反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑.
故答案为:①②⑤⑧;
(2)非电解质是在熔融状态和水溶液中都不导电的化合物,④液氨属于非电解质; ⑥蔗糖溶液是混合物不是非电解质 ⑦无水乙醇是非电解质 ⑩CO2是非电解质,
故答案为:④⑦⑩;
(3)NaHCO3是盐,在水溶液中完全电离出Na+和HCO3-,电离方程式为:NaHCO3═Na++HCO3-,故答案为:NaHCO3═Na++HCO3-;
(4)NaOH 与NaHSO4 反应生成硫酸钠和水,其反应的离子方程式为:OH-+H+═H2O,故答案为:OH-+H+═H2O;
(5)Al与氢氧化钠溶液反应生成偏铝酸钠和氢气,其反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑.
点评:本题考查电解质和非电解质的判断、离子方程式和电离方程式的书写等知识,题目难度不大,注意能导电的物质的类别.

练习册系列答案
相关题目
下列与化学反应能量变化相关的叙述中正确的是( )
| A、已知CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802 kJ/mol,甲烷的燃烧热为802 kJ/mol |
| B、等量H2在O2中完全燃烧,生成H2O(g)比生成H2O(l)放出的热量多 |
| C、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
| D、由石墨比金刚石稳定可知:C(金刚石,s)═C(石墨,s)△H<0 |
 如图是关于反应A2(g)+B2(g)?2C(g)+D(g)△H<0的平衡移动图象,影响平衡移动的原因可能是( )
如图是关于反应A2(g)+B2(g)?2C(g)+D(g)△H<0的平衡移动图象,影响平衡移动的原因可能是( )| A、升高温度,同时加压 |
| B、压强不变,降低温度 |
| C、压强、温度不变,充入一些与之不反应的惰性气体 |
| D、温度、压强不变,充入一些A2(g) |
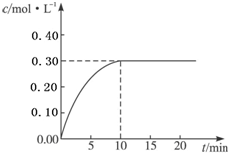 (1)氢能作为一种新型能源具有燃烧热值高、资源丰富、燃烧产物无污染等优点.已知燃烧4g H2生成液态水时放热为571.6kJ,试写出表示H2燃烧热的热化学方程式
(1)氢能作为一种新型能源具有燃烧热值高、资源丰富、燃烧产物无污染等优点.已知燃烧4g H2生成液态水时放热为571.6kJ,试写出表示H2燃烧热的热化学方程式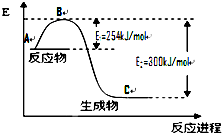 氮是地球上含量丰富的一种元素,氮及其化合物在工 农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在工 农业生产、生活中有着重要作用.