题目内容
下列气体溶解于水,且发生氧化还原反应的是( )
| A、SO2溶解于水 |
| B、NO2溶解于水 |
| C、NH3溶解于水 |
| D、Cl2溶解于水 |
考点:氮的氧化物的性质及其对环境的影响,氯气的化学性质
专题:卤族元素,氮族元素
分析:发生的反应中,存在元素的化合价变化,则发生了氧化还原反应,以此来解答.
解答:
解:A.二氧化硫溶于水反应生成亚硫酸,没有元素的化合价变化,不发生氧化还原反应,故A不选;
B.二氧化氮溶于水反应生成硝酸和NO,N元素的化合价变化,发生了氧化还原反应,故B选;
C.反应生成一水合氨,没有元素的化合价变化,不发生氧化还原反应,故C不选;
D.氯气溶于水和水反应生成盐酸和次氯酸,有元素的化合价变化,发生氧化还原反应,故D选;
故选BD.
B.二氧化氮溶于水反应生成硝酸和NO,N元素的化合价变化,发生了氧化还原反应,故B选;
C.反应生成一水合氨,没有元素的化合价变化,不发生氧化还原反应,故C不选;
D.氯气溶于水和水反应生成盐酸和次氯酸,有元素的化合价变化,发生氧化还原反应,故D选;
故选BD.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,注意酸性氧化物的性质及发生的化学反应,题目难度不大.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案
相关题目
常温条件下,一密闭容器中以1:2:3的比例充入NO、N2、NO2,在条件不变的情况下,向容器中充入与NO2等体积的O2,充分反应后,有关容器中的气体的下列叙述中正确的是(不考虑NO2转化为N2O4)( )
| A、NO、N2、NO2、O2的体积比为1:2:3:3 |
| B、N2、NO2、O2的体积比为2:3:2 |
| C、NO、NO2、O2的体积比为4:3:1 |
| D、N2、NO2、O2的体积比为4:8:5 |
标准状况下,将4.48L的NO2和NO组成的混合气体通入100mL的水中,气体体积缩小为2.24L,假设溶液的体积不变,则下列说法中错误的是( )
| A、所得溶液中溶质的物质的量浓度为1.0mol?L-1 |
| B、剩余气体中氮元素与氧元素的质量为8:7 |
| C、原混合气体中NO2和NO的体积比为1:1 |
| D、反应过程中转移的电子总数为0.1mol |
一定不是同分异构体的一组物质是( )
| A、含相同碳原子数的饱和醛和酮 |
| B、含相同碳原子数的饱和一元羧酸与酯 |
| C、乙醇与乙醚 |
| D、对甲苯酚与苯甲醇 |
下列电离方程式书写不正确的是( )
| A、Al(OH)3?Al3++3OH- |
| B、NaHCO3═Na++HCO3-HCO-3?H++CO32- |
| C、Na2SO4=2Na++SO42- |
| D、HF?H++F- |
C、N、S都是重要的非金属元素.下列说法正确的是( )
| A、三者对应的氧化物均为酸性氧化物 |
| B、三者的单质直接与氧气反应都能生成两种以上氧化物 |
| C、同浓度的Na2CO3、NaNO3、Na2SO3溶液的导电能力相同 |
| D、CO2、NO2、SO2都能与H2O反应生成电解质 |
已知碱能除去硝酸工业废气中的NO2和NO:NO2+NO+2NaOH═2NaNO2+H2O;2NO2+2NaOH═NaNO2+NaNO3+H2O.根据上述反应原理,下列气体中不能被过量的NaOH吸收的是( )
| A、1mol O2和4mol NO2 |
| B、1mol NO和4mol NO2 |
| C、1mol O2和4mol NO |
| D、1mol NO2和4mol NO |
下列化学用语使用正确的是( )
A、氟化镁的电子式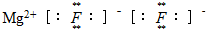 |
B、用电子式表示硫化氢的形成过程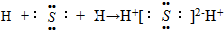 |
| C、HClO的结构式 H-O-Cl |
D、Cl-离子的结构示意图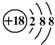 |