题目内容
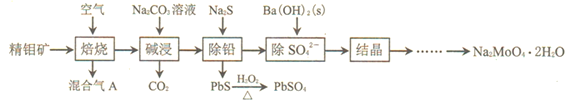
【题目】钼酸钠(Na2MoO4)可与重金属盐产生沉淀,是目前应用较多的一种新型水处理剂。利用精钼矿![]() 主要成分是MoS2,含少量PbS等
主要成分是MoS2,含少量PbS等![]() 来制取钼酸钠晶体的工艺流程如下图所示。
来制取钼酸钠晶体的工艺流程如下图所示。
请回答下列问题:
⑴混合气A中含有一种大气污染物,其化学式为___________。
⑵焙烧的过程中采用如图1所示的“多层逆流焙烧”。
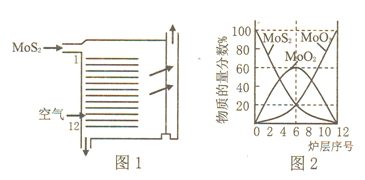
①多层逆流焙烧的优点是___________![]() 任答两点
任答两点![]() 。
。
②依据如图2,写出第6—12层MoO2参加反应的化学方程式___________。
⑶写出碱浸时发生反应的离子方程式___________。
⑷PbS与H2O2反应时,温度高于40℃后,反应速率反而减慢,原因是___________。
⑸流程图中“除SO42-”的过程中,当BaMoO4开始沉淀时,SO42-的去除率为97.0%,已知原Na2MoO4溶液中c(MoO42-)=0.48mol/L, c(SO42-)=0.040mol/L,Ksp(BaSO4) = 1.0×10-10,则Ksp(BaMoO4) = ___________。![]() 过程中溶液体积变化忽略不计
过程中溶液体积变化忽略不计![]()
⑹锂和二硫化钼形成的二次电池的总反应为:xLi + nMoS2![]() Lix(MoS2)n,则电池放电时的正极反应式是___________。
Lix(MoS2)n,则电池放电时的正极反应式是___________。
【答案】SO2 增长钼精矿与空气接触的时间和增大接触面积,使其充分反应,提高原料的利用率、实现热量交换,节约能源 2MoO2 + O2![]() 2MoO3 MoO3 + CO32-= MoO42-+ CO2↑ 温度高于40℃后,H2O2分解,浓度减小,反应速率减慢
2MoO3 MoO3 + CO32-= MoO42-+ CO2↑ 温度高于40℃后,H2O2分解,浓度减小,反应速率减慢 ![]() nMoS2 + xLi+ + xe- = Lix(MoS2)n
nMoS2 + xLi+ + xe- = Lix(MoS2)n
【解析】
⑴根据工艺流程图和元素分析可知大气污染物;
⑵①多层逆流焙烧的优点是增长钼精矿与空气接触的时间和增大接触面积,使其充分反应,提高原料的利用率、实现热量交换,节约能源;②依据如图2,可知第![]() 层MoO2转化为MoO3;
层MoO2转化为MoO3;
⑶根据工艺流程图可知,碱浸时MoO3 转化为MoO42-的离子方程式;
⑷因温度高于40℃后,H2O2分解,浓度减小;
⑸由题意可知,根据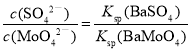 ,再进行计算;
,再进行计算;
⑹由总反应可知,电池放电时的正极MoS2得到电子,写出电极应式。
⑴根据工艺流程图可知,混合气A中含有的一种大气污染物为二氧化硫,其化学式为:SO2;
故答案为:SO2;
⑵①多层逆流焙烧的优点是增长钼精矿与空气接触的时间和增大接触面积,使其充分反应,提高原料的利用率、实现热量交换,节约能源;
故答案为:增长钼精矿与空气接触的时间和增大接触面积,使其充分反应,提高原料的利用率、实现热量交换,节约能源;
②依据如图2,可知第![]() 层MoO2转化为MoO3,其参加反应的化学方程式为:2MoO2 + O2
层MoO2转化为MoO3,其参加反应的化学方程式为:2MoO2 + O2![]() 2MoO3;
2MoO3;
故答案为:2MoO2 + O2![]() 2MoO3;
2MoO3;
⑶根据工艺流程图可知,碱浸时发生反应的离子方程式为:MoO3 + CO32-= MoO42-+CO2↑;
故答案为:MoO3 + CO32- = MoO42- + CO2↑;
⑷因温度高于40℃后,H2O2分解,浓度减小,PbS与H2O2的反应速率减慢;
故答案为:温度高于40℃后,H2O2分解,浓度减小,反应速率减慢;
⑸由题意可知,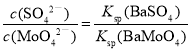 ,
,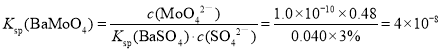 ;
;
故答案为:![]() ;
;
⑹由总反应可知,电池放电时的正极反应式为:nMoS2 + xLi+ + xe- = Lix(MoS2)n;
故答案为:nMoS2 +xLi+ + xe-= Lix(MoS2)n。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案