题目内容
1.400℃时,将一定量的SO2和l4mol O2压入一个盛有催化剂的10L密闭容器中进行反应;2SO2+O2?2SO3已知2min后,容器中剩余2mol SO2和12mol O2.试计算:
(1)生成SO3的物质的量4mol.
(2)SO2的起始物质的量浓度0.6mol/L.
(3)2min内SO2反应速率0.2mol/(L.min)SO3的反应速率0.2mol/(L.min).
(4)开始时与2min末压强比10:9.
分析 设开始二氧化硫的物质的量为x,2min后,容器中剩余2mol SO2和12mol O2,可知转化的氧气为2mol,则
2SO2+O2?2SO3
开始 x 14 0
转化 4 2 4
2mim 2 12 4
然后结合c=$\frac{n}{V}$、v=$\frac{△c}{△t}$、相同条件下压强比等于物质的量比来解答.
解答 解:设开始二氧化硫的物质的量为x,2min后,容器中剩余2mol SO2和12mol O2,可知转化的氧气为14mol-12mol=2mol,则
2SO2+O2?2SO3
开始 x 14 0
转化 4 2 4
2mim 2 12 4
(1)由上述分析可知,生成SO3的物质的量为4mol,故答案为:4mol;
(2)SO2的起始物质的量浓度为$\frac{4mol+2mol}{10L}$=0.6mol/L,故答案为:0.6mol/L;
(3)2min内SO2反应速率为$\frac{\frac{4mol}{10L}}{2min}$=0.2mol/(L.min),反应速率之比等于化学计量数之比,则SO3的反应速率为0.2mol/(L.min),
故答案为:0.2mol/(L.min);0.2mol/(L.min);
(4)相同条件下压强比等于物质的量比,则开始时与2min末压强比为(6mol+14mol):(2mol+12mol+4mol)=10:9,故答案为:10:9.
点评 本题考查化学平衡的计算,为高频考点,把握化学反应三段法计算格式为解答的关键,侧重分析与计算能力的考查,注意白压强与物质的量的关系,题目难度不大.

| A. | CH4和C10 H22 | B. | 1-己烯和环己烷 | C. | C2H4和1-丁烯 | D. | 乙二醇和丙三醇 |
| A. | HO(CH2)2CHO | B. | CH3COOH | C. | HOOCCOOH | D. | HO(CH2)2COOH |

| A. | 一定含有Na+,可能存在K+ | |
| B. | 至少存在4种离子 | |
| C. | 无色气体是NO气体 | |
| D. | 白色沉淀甲中一定含有BaSO4和BaCO3 |
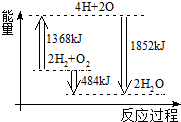
| A. | 拆开2 mol H2(g)和1 mol O2(g)中的化学键成为H、O原子,共放出1368 kJ能量 | |
| B. | 由H、O原子形成2 mol H2O(g),共吸收1852 kJ能量 | |
| C. | 2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(l),共吸收484 kJ能量 | |
| D. | 2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(g),共放出484 kJ能量 |
