题目内容
16.下列离子方程式改写成化学方程式正确的是( )| A. | Cu2++2OH-═Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO32-+2H+═CO2↑+H2O BaCO3+2HCl═BaCl2+CO2↑+H2O | |
| C. | Ca2++CO32-═CaCO3↓ Ca(NO3)2+NaCO3═CaCO3↓+NaNO3 | |
| D. | H++OH-═H2O 2KOH+H2SO4═K2SO4+2H2O |
分析 A、CuCO3是沉淀,不能拆;
B、BaCO3是沉淀,不能拆;
C、碳酸钠的化学式书写错误;
D、离子方程式H++OH-═H2O是强酸和强碱反应生成可溶性盐和水这一类酸碱中和反应的离子方程式.
解答 解:A、CuCO3是沉淀,不能拆,故Cu2+对应的化合物不能选CuCO3,只能选可溶性铜盐,故A错误;
B、BaCO3是沉淀,不能拆,故CO32-对应的化合物不能选BaCO3,只能选可溶性碳酸盐如碳酸钠,故B错误;
C、碳酸钠的化学式书写错误,应为Na2CO3,故C错误;
D、离子方程式H++OH-═H2O是强酸和强碱反应生成可溶性盐和水这一类酸碱中和反应的离子方程式,故可以改写成 2KOH+H2SO4═K2SO4+2H2O,故D正确.
故选D.
点评 本题考查了离子方程式的书写,明确反应的实质是解题关键,注意离子方程式书写应符合客观规律、应遵循原子个数、电荷数守恒.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.CO是一种有毒气体,工业上可利用CO和H2在一定条件下合成有机燃料甲醇,实现变废为宝,节约资源的目的.回答下列问题:
(1)已知:①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)=CH3OH(g)△H3=-90.8kJ•mol-1
则表示CH3OH蒸汽燃烧热的热化学方程式为CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l),△H=-763.8kJ•mol-1.
(2)在一定温度下,按下表中的物质的量投入容积为2L的恒容密闭容器中,发生反应:CO(g)+2H2(g)=CH3OH(g)△H3=-90.8kJ•mol-1,得到如下数据:
①按实验2中的量投入容器,反应向正(填“正”或“逆”)方向进行,达到平衡时CO的转化率为50%(保留一位小数)
②750℃,该反应的平衡常数K=1.56(保留两位小数)
③已知750℃时,若实验4在体积可变的恒压密闭容器中反应,达到平衡时CO的体积分数为W%,相同条件下,若起始时容器中加入xmolCO、ymolH2和0.4molCH3OH气体,达到平衡时,欲保持CO的体积分数仍为W%,则x、y应满足的条件是x:y=1:2(用含x、y的式子表示).
(3)利用甲醇通过如图装置电解精炼铜,请回答下列问题:
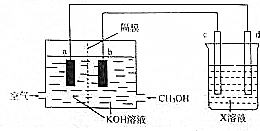
①应选粗铜作d电极的电极材料,C电极的名称为阴极,X溶液为硫酸铜溶液;
②b电极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O;
③电解精炼过程中a电极附近溶液的pH会增大(填“增大”、“减小”或“不变”)
(1)已知:①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)=CH3OH(g)△H3=-90.8kJ•mol-1
则表示CH3OH蒸汽燃烧热的热化学方程式为CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l),△H=-763.8kJ•mol-1.
(2)在一定温度下,按下表中的物质的量投入容积为2L的恒容密闭容器中,发生反应:CO(g)+2H2(g)=CH3OH(g)△H3=-90.8kJ•mol-1,得到如下数据:
| 实验组序 | 温度/℃ | 起始量/mol | 平衡量/mol | ||||
| CO(g) | H2(g) | CH3OH(g) | CH3OH(g) | ||||
| 1 | 500 | 2 | 4 | 0 | 1 | ||
| 2 | 500 | 1.4 | 2.8 | 0.6 | a | ||
| 3 | 750 | 0 | 0 | 2 | 0.8 | ||
| 4 | 750 | 0.8 | 1.6 | 1.2 | b | ||
②750℃,该反应的平衡常数K=1.56(保留两位小数)
③已知750℃时,若实验4在体积可变的恒压密闭容器中反应,达到平衡时CO的体积分数为W%,相同条件下,若起始时容器中加入xmolCO、ymolH2和0.4molCH3OH气体,达到平衡时,欲保持CO的体积分数仍为W%,则x、y应满足的条件是x:y=1:2(用含x、y的式子表示).
(3)利用甲醇通过如图装置电解精炼铜,请回答下列问题:

①应选粗铜作d电极的电极材料,C电极的名称为阴极,X溶液为硫酸铜溶液;
②b电极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O;
③电解精炼过程中a电极附近溶液的pH会增大(填“增大”、“减小”或“不变”)
4.常温下,下列各组离子一定能大量共存的是( )
| A. | 无色溶液:Na+、Fe3+、NO3-、OH- | |
| B. | 滴加酚酞溶液呈红色:K+、NO3-、H+、HCO3- | |
| C. | 0.1 mol•L-1 CaCl2的溶液中:Na+、K+、CO32-、SO42- | |
| D. | 能与Mg反应生成H2的溶液:Na+、K+、SO42-、H+ |
11.以下反应属于加成反应的是( )
| A. | 乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯使溴的四氯化碳溶液褪色 | |
| C. | 甲烷与氯气混合光照一段时间后黄绿色褪色 | |
| D. | 乙烯在催化剂作用下生成聚乙烯 |
6.在酸性溶液中能大量共存的离子组是( )
| A. | OH-、HCO3-、Na+ | B. | Cu2+、NH4+、OH- | C. | Ba2+、K+、NO3- | D. | Ag+、Cl-、SO42- |