题目内容
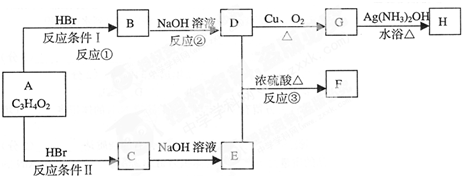
如图是向盛有0.2 mol/L50ml明矾溶液中,慢慢加入0.1mol/L Ba(OH)2溶液,生成沉淀的质量随着加入Ba(OH)2 溶液的体积变化图象,当产生的沉淀量最大时(即B点)改为加入0.5mol/L的HCl,沉淀量又发生变化(虚线部分).
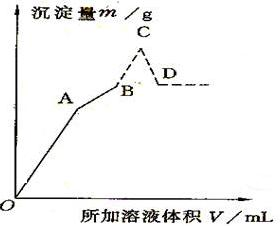
(1)写出OA、AB、BC、CD四点发生的化学方程式.
(2)计算A、B、C、D点加入氢氧化钡溶液和盐酸的体积及对应沉淀的质量,HCl并填入下表:

(1)写出OA、AB、BC、CD四点发生的化学方程式.
(2)计算A、B、C、D点加入氢氧化钡溶液和盐酸的体积及对应沉淀的质量,HCl并填入下表:
| A | B | C | D | |
| V[Ba(OH)2 (aq)]/ml | ||||
| V[HCl(aq)]/ml | ||||
| M沉淀/g |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:向明矾溶液中加入氢氧化钡溶液时,反应方程式依次为:OA段:2KAl(SO4)2+3Ba(OH)2=K2SO4+BaSO4↓+2Al(OH)3↓,AB段:K2SO4+Ba(OH)2=BaSO4↓+2KOH,和2Al(OH)3+Ba(OH)2=Ba[Al(OH)4]2,B点后再加入盐酸反应方程式依次为,BC段:Ba[Al(OH)4]2+2HCl=2Al(OH)3↓+BaCl2+2H2O和KOH+HCl=KCl+H2O,CD段:Al(OH)3+3HCl=AlCl3+3H2O,据此分析.
解答:
解:(1)向明矾溶液中加入氢氧化钡溶液时,反应方程式依次为:OA段:2KAl(SO4)2+3Ba(OH)2=K2SO4+BaSO4↓+2Al(OH)3↓,AB段:K2SO4+Ba(OH)2=BaSO4↓+2KOH,和2Al(OH)3+Ba(OH)2=Ba[Al(OH)4]2,B点后再加入盐酸反应方程式依次为,BC段:Ba[Al(OH)4]2+2HCl=2Al(OH)3↓+BaCl2+2H2O和KOH+HCl=KCl+H2O,CD段:Al(OH)3+3HCl=AlCl3+3H2O,
故答案为:OA段:K2SO4+Ba(OH)2=BaSO4↓+2KOH、2Al(OH)3+Ba(OH)2=Ba[Al(OH)4]2,
AB段:K2SO4+Ba(OH)2=BaSO4↓+2KOH,和2Al(OH)3+Ba(OH)2=Ba[Al(OH)4]2,
BC段:Ba[Al(OH)4]2+2HCl=2Al(OH)3↓+BaCl2+2H2O和KOH+HCl=KCl+H2O,
CD段:Al(OH)3+3HCl=AlCl3+3H2O;
(2)A点:OA段反应为:2KAl(SO4)2+3Ba(OH)2=K2SO4+BaSO4↓+2Al(OH)3↓,0.2 mol/L50ml明矾溶液中有KAl(SO4)20.01mol,且Al完全沉淀,据反应方程式2KAl(SO4)2+3Ba(OH)2=K2SO4+BaSO4↓+2Al(OH)3↓可知,OA段生成氢氧化铝沉淀0.01mol,硫酸钡沉淀
×0.02mol=0.015mol,消耗Ba(OH)2物质的量为
×0.01mol=0.015mol,溶液体积为:
=0.15L,生成K2SO4物质的量为0.005mol,生成沉淀BaSO4和Al(OH)3的质量分别为:0.015mol×233g/mol=3.495g和0.01mol×78g/mol=0.78g,共4.275g;
B点:AB段反应为:K2SO4+Ba(OH)2=BaSO4↓+2KOH,和2Al(OH)3+Ba(OH)2=Ba[Al(OH)4]2,0.01molAl(OH)3生成Ba[Al(OH)4]2的物质的量为0.005mol,B点沉淀全部为BaSO4,其质量为0.02mol×233g/mol=4.66g,0.005molK2SO4和0.01molAl(OH)3共消耗Ba(OH)2的物质的量为0.005mol+
×0.01mol=0.01mol,溶液体积为
=0.1L;
C点:BC段反应方程式为:Ba[Al(OH)4]2+2HCl=2Al(OH)3↓+BaCl2+2H2O和KOH+HCl=KCl+H2O,0.005molBa[Al(OH)4]2生成Al(OH)3沉淀0.01mol,沉淀质量为0.01mol×78g/mol=0.78g,C点沉淀质量为:4.275g+0.78g=5.055g,0.005molBa[Al(OH)4]2和0.01molKOH共消耗HCl0.02mol,消耗盐酸体积为
=0.04L;
D点:CD段反应方程式为:Al(OH)3+3HCl=AlCl3+3H2O,0.01molAl(OH)3消耗盐酸0.03mol,
=0.06L,沉淀质量与B点相同为4.66g;
故答案为:
故答案为:OA段:K2SO4+Ba(OH)2=BaSO4↓+2KOH、2Al(OH)3+Ba(OH)2=Ba[Al(OH)4]2,
AB段:K2SO4+Ba(OH)2=BaSO4↓+2KOH,和2Al(OH)3+Ba(OH)2=Ba[Al(OH)4]2,
BC段:Ba[Al(OH)4]2+2HCl=2Al(OH)3↓+BaCl2+2H2O和KOH+HCl=KCl+H2O,
CD段:Al(OH)3+3HCl=AlCl3+3H2O;
(2)A点:OA段反应为:2KAl(SO4)2+3Ba(OH)2=K2SO4+BaSO4↓+2Al(OH)3↓,0.2 mol/L50ml明矾溶液中有KAl(SO4)20.01mol,且Al完全沉淀,据反应方程式2KAl(SO4)2+3Ba(OH)2=K2SO4+BaSO4↓+2Al(OH)3↓可知,OA段生成氢氧化铝沉淀0.01mol,硫酸钡沉淀
| 3 |
| 4 |
| 3 |
| 2 |
| 0.015mol |
| 0.1mol/L |
B点:AB段反应为:K2SO4+Ba(OH)2=BaSO4↓+2KOH,和2Al(OH)3+Ba(OH)2=Ba[Al(OH)4]2,0.01molAl(OH)3生成Ba[Al(OH)4]2的物质的量为0.005mol,B点沉淀全部为BaSO4,其质量为0.02mol×233g/mol=4.66g,0.005molK2SO4和0.01molAl(OH)3共消耗Ba(OH)2的物质的量为0.005mol+
| 1 |
| 2 |
| 0.01mol |
| 0.1mol/L |
C点:BC段反应方程式为:Ba[Al(OH)4]2+2HCl=2Al(OH)3↓+BaCl2+2H2O和KOH+HCl=KCl+H2O,0.005molBa[Al(OH)4]2生成Al(OH)3沉淀0.01mol,沉淀质量为0.01mol×78g/mol=0.78g,C点沉淀质量为:4.275g+0.78g=5.055g,0.005molBa[Al(OH)4]2和0.01molKOH共消耗HCl0.02mol,消耗盐酸体积为
| 0.02mol |
| 0.5mol/L |
D点:CD段反应方程式为:Al(OH)3+3HCl=AlCl3+3H2O,0.01molAl(OH)3消耗盐酸0.03mol,
| 0.03mol |
| 0.5mol/L |
故答案为:
| A | B | C | D | |
| V[Ba(OH)2(aq)/mL | 150 | 100 | ||
| V[HCl(aq)]/mL | 40 | 60 | ||
| M沉淀/g | 4.275 | 4.66 | 5.055 | 4.66 |
点评:本题综合性较强,不仅需掌握硫酸钡是难溶于碱的盐,还需掌握氢氧化铝的两性,掌握怎样从图中获取信息,怎样利用有关数据进行计算.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
工业上,用辉铜矿(Cu2S)炼铜的方法之一是:①将矿石在高温下鼓入空气煅烧,生成两种氧化物;②将煅烧过的矿石加上比它质量约少一半的未经煅烧过的矿石,混合后隔绝空再进行高温煅烧,结果得到铜和一种有刺激性气味的气体.下列对反应①和②的推断不正确的是( )
| A、反应①和②的氧化产物都是S02 |
| B、反应①的氧化产物与还原产物物质的量之比为1:1 |
| C、等物质的量的硫化亚铜在反应①和②中完全反应,转移的电子数相等 |
| D、反应②中,硫化亚铜既是氧化剂又是还原剂 |
下列表达方式正确的是( )
A、碳-12原子
| ||
B、羟基电子式 | ||
C、硫离子结构示意图 | ||
D、CH4S的结构式 |
下列物质为纯净物的是( )
| A、冰醋酸 | B、医用酒精 |
| C、福尔马林 | D、汽油 |

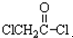 与足量的NaOH溶液共热充分反应的化学方程式:
与足量的NaOH溶液共热充分反应的化学方程式: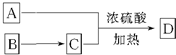 所示转化关系,D的分子式为C10H12O3,A与C反应的化学方程式
所示转化关系,D的分子式为C10H12O3,A与C反应的化学方程式