题目内容
14.实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如图1: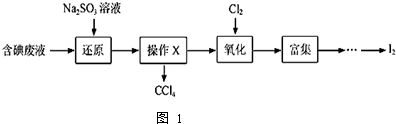
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为SO32-+I2+H2O=2I-+SO42-+2H+;该操作将I2还原为I-的目的是使CCl4中的碘进入水层.
(2)操作X的名称为分液.
(3)氧化时,在三颈瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在400C左右反应(实验装置如图2所示).实验控制在较低温度下进行的原因是使氯气在溶液中有较大的溶解度(或防止I2升华或防止I2进一步被氧化);锥形瓶里盛放的溶液为NaOH溶液.
(4)利用如图3所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2.
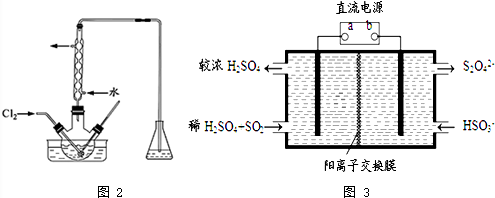
①a为电源的正极(填“正极”或“负极”),阳极的电极反应式为SO2+2H2O-2e-=SO42-+4H+.
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成.该反应中氧化剂与还原剂的物质的量之比为1:2.
分析 碘废液加亚硫酸钠溶液,把单质碘还原为I-,四氯化碳难溶于水,会分层,则分液即可得到四氯化碳,剩余的溶液中加氯气氧化I-得到I2,富集,最后得到较纯的I2,
(1)碘具有氧化性,能氧化亚硫酸钠生成硫酸钠,自身被还原生成碘;碘微溶于水,而碘离子易溶于水;
(2)分离互不相溶的液体采用分液的方法分离,四氯化碳属于有机物,水属于无机物,二者不互溶;
(3)碘易升华,且氯气的溶解度随着温度的升高而减小;氯气、碘蒸气都能和氢氧化钠溶液反应生成无毒物质;
(4)①根据电解池中阳极发生氧化反应,与电源正极相连的为阳极可以判断①图中a极要连接电源的正极;依据电极原理和反应过程中的离子变化写出电极反应;
②二氧化硫被氧化为硫酸根,所以二氧化硫所在的区为阳极区,a为正电源极,b为电源负极,依据在碱性条件下,阴极排出的溶液为S2O42-,二氧化氮与其发生反应4S2O42-+2NO2+8OH-═8SO42-+N2+4H2O,依据方程式即可解答.
解答 解:(1)碘具有氧化性,能氧化亚硫酸钠生成硫酸钠,自身被还原生成碘离子,离子反应方程式为SO32-+I2+H2O=2I-+2H++SO42-;碘微溶于水,而碘离子易溶于水,为了使更多的I元素进入水溶液应将碘还原为碘离子;
故答案为:SO32-+I2+H2O=2I-+2H++SO42-;使CCl4中的碘进入水层;
(2)四氯化碳属于有机物,水属于无机物,二者不互溶,分离互不相溶的液体采用分液的方法分离,所以分离出四氯化碳采用分液的方法;
故答案为:分液;
(3)碘易升华,且氯气的溶解度随着温度的升高而减小,温度越高,氯气的溶解度越小,反应越不充分,所以应该在低温条件下进行反应;氯气、碘蒸气都有毒,不能直接排空,且都能和氢氧化钠溶液反应生成无毒物质,所以用NaOH溶液吸收氯气和碘蒸气,
故答案为:使氯气在溶液中有较大的溶解度(或防止碘升华或防止碘进一步被氧化);NaOH溶液;
(4)①依据图示可知,二氧化硫被氧化为硫酸根,所以二氧化硫所在的区为阳极区,a为正电源极,b为电源负极;阳极区发生反应SO2-2e-+2H2O═SO42-+4H+,
故答案为:正极;O2+2H2O-2e-=SO42-+4H+;
②阴极排出的溶液为S2O42-,二氧化氮与其发生反应,S2O42-中硫元素由+3价,变为硫酸根中硫元素为+4价,S2O42-被氧化是还原剂;二氧化氮中的氮元素化合价为+4价变为氮气0价,二氧化氮被还原为氧化剂,依据原子守恒和得失电子守恒可得,发生的离子方程式为4S2O42-+2NO2+8OH-═8SO42-+N2+4H2O,所以该反应中氧化剂与还原剂的物质的量之比为1:2,
故答案为:1:2.
点评 本题考查了有关SO2和NOx的知识,分析利用题干信息,明确物质的性质是解本题关键,根据物质的特殊性质、混合物分离和提纯方法的选取等方面来分析解答,知道碘的检验方法,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 按系统命名法,化合物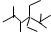 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 可用热的饱和Na2CO3溶液除去金属表面的机油、润滑油 | |
| C. | C4H10的一氯取代物有4种 | |
| D. | 用酸性KMnO4溶液可鉴别2-丁烯和正丁醛 |
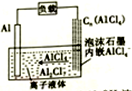 最近报道的一种能快速充放电的离子电池,其中的电解质为离子液体{AlCl4-/[EMI]+},放电时有关离子转化如图所示.下列说法正确的是 ( )
最近报道的一种能快速充放电的离子电池,其中的电解质为离子液体{AlCl4-/[EMI]+},放电时有关离子转化如图所示.下列说法正确的是 ( )| A. | 放电时,负极发生2AlCl4--e-═Al2Cl7-+Cl- | |
| B. | 放电时,有机阳离子[EMI]+向铝电极方向移动 | |
| C. | 充电时,阴极发生:4Al2Cl7-+3e-═Al+7AlCl4- | |
| D. | 充电时,泡沫石墨极与外电源的负极相连 |
| 选项 | 目的 | 实验 | 现象 |
| A | 检验CO2气体中混有SO2 | 将气体通入盛有足量的澄清石灰水中的洗气瓶中 | 石灰水变浑浊 |
| B | 检验黑色固体Fe3O4中含有+3价铁元素 | 将少量黑色固体加入盛有KSCN溶液的烧杯中 | 固体溶解,溶液呈血红色 |
| C | 实验室制取并收集少量NH3 | 加热NH4Cl固体,并用向上排空气法收集,将湿润的红色石蕊试纸放在瓶口 | NH4Cl固体逐渐变少,湿润的红色石蕊试纸变蓝色 |
| D | 验证氧化性:Fe3+>Cu2+ | 将一定量铜粉加到盛有一定体积的1.0mol•L-1Fe2(SO4)3溶液的试管中 | 铜粉溶解,溶液变蓝色 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 0.1molCl2常温下与过量稀NaOH溶液反应转移电子总数为0.1NA | |
| B. | 25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 标准状况下,22.4LCHCl3含有的分子数为NA | |
| D. | 1L 0.1mol•L-1的硫化钠溶液中硫离子数目为0.1NA |

| A. | 甲是甲烷,甲烷的二氯取代产物只有一种结构 | |
| B. | 乙是乙烯,乙烯可与溴水发生取代反应使溴水褪色 | |
| C. | 丙是苯,苯结构比较稳定,不能发生氧化反应 | |
| D. | 丁是乙酸,一定条件下乙酸能跟乙醇发生酯化反应 |
 ,实验式是CH2.
,实验式是CH2.
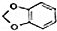
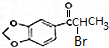 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +NaBr+H2O
+NaBr+H2O (写出其中一种的结构简式).
(写出其中一种的结构简式). 的合成路线.
的合成路线. $→_{△}^{Cl_{2}}$
$→_{△}^{Cl_{2}}$ $→_{AlCl_{3}}^{CH_{3}CHO}$
$→_{AlCl_{3}}^{CH_{3}CHO}$ $→_{H_{2}SO_{4}}^{NaBr/FeBr_{2}}$
$→_{H_{2}SO_{4}}^{NaBr/FeBr_{2}}$ $→_{△}^{NaOH水溶液}$
$→_{△}^{NaOH水溶液}$ .
.