题目内容
1. 向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示.
向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示.(1)横坐标0~1段反应的离子方程式为:Fe+NO3-+4H+=Fe3++NO↑+2H2O.
(2)忽略溶液体积的变化,则原溶液Cu(NO3)2的浓度为1mol/L.
分析 根据氧化性:HNO3>Fe3+>Cu2+,Fe先与氧化性强的物质反应,0~1段发生反应:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,1~2段发生反应:Fe+2Fe3+=3Fe2+,2~3段发生反应Fe+Cu2+═Fe2++Cu,据此结合图象数据进行计算.
解答 解:(1)根据氧化性:HNO3>Fe3+>Cu2+,0~1段为Fe与硝酸反应,反应方程式为:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,反应的离子方程式为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,
故答案为:Fe+NO3-+4H+=Fe3++NO↑+2H2O;
(2)原溶液中的硝酸根离子来自硝酸铁、硝酸铜和硝酸,
0~1段发生反应为Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,总共消耗1molFe,则原溶液中含有硝酸的物质的量为1mol×$\frac{4}{1}$=4mol,同时反应生成1mol硝酸铁;
1~2段发生反应为Fe+2Fe3+=3Fe2+,该段消耗1molFe,则生成的亚铁离子的物质的量为:1mol×3=3mol,亚铁离子浓度为3mol/L,则该溶液体积为1L;此时溶液中消耗硝酸铁的物质的量为:1mol×2=2mol,则原溶液中含有硝酸铁的物质的量为:2mol-1mol=1mol;
2~3段发生反应为Fe+Cu2+═Fe2++Cu,该段总共消耗1mol铁,说明原溶液中含有硝酸铜的物质的量为1mol,
原溶液Cu(NO3)2的浓度=;
该溶液体积为1L,则原溶液Cu(NO3)2的浓度为:c(Cu(NO3)2)=$\frac{1mol}{1L}$=1mol/L,
故答案为:1mol/L.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握质量守恒定律在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

| A. | 醋酸除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 碘水中通入足量的SO2:I2+SO2+2H2O=2I-+SO42-+4H+ | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| D. | 惰性电极电解MgCl2溶液:Cl-+2H2O=2OH-+H2↑+Cl2↑ |
 一种植物生长调节的结构简式如图所示,下列说法不正确的是( )
一种植物生长调节的结构简式如图所示,下列说法不正确的是( )| A. | 该物质含有3种官能团 | B. | 该物质属于脂环烃 | ||
| C. | 该物质属于多官能团化合物 | D. | 该物质属于烃的衍生物 |
| A. | 物质的量浓度相同的盐酸和CH3COOH溶液 | |
| B. | 物质的量浓度相同的NaOH溶液和氨水 | |
| C. | pH=3的盐酸和pH=3的NH4Cl溶液均稀释100倍所得溶液 | |
| D. | pH=10的NaOH溶液和pH=10的CH3COONa溶液均稀释100倍所得溶液 |
| A. | SO2、CO2、CO、NO2都是酸性氧化物 | |
| B. | Na2O、Na2O2、Fe2O3、CuO都是碱性氧化物 | |
| C. | HCI、HClO、HClO3、HClO4都是强酸 | |
| D. | NaOH、KOH、Ba(OH)2都是强碱 |
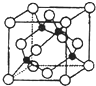 周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子.工业上通过分离液态空气获得X单质.Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和.Z基态原子的最外能层只有一个电子,其他能层均已充满电子.
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子.工业上通过分离液态空气获得X单质.Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和.Z基态原子的最外能层只有一个电子,其他能层均已充满电子.