题目内容
18.下列反应中硫酸既表现了氧化性,又表现了酸性的是( )| A. | Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O | B. | NaCl+H2SO4(浓)═NaHSO4+HCl↑ | ||
| C. | C+2H2SO4(浓)═2SO2↑+CO2↑+2H2O | D. | H2SO4+Na2SO3═Na2SO4+H2O+SO2↑ |
分析 硫酸既能表现出酸性又表现出氧化性,在反应中应生成硫酸盐,且硫酸被还原生成二氧化硫等物质,据此解答.
解答 解:A.铜与浓硫酸反应生成硫酸铜、二氧化硫和水,硫酸既表现出了强氧化性又表现了酸性,故A选;
B.NaCl+H2SO4(浓)═NaHSO4+HCl↑不挥发性的制挥发性的酸,只表现硫酸的难挥发性,故B不选;
C.木炭粉与浓硫酸反应生成二氧化碳和二氧化硫、水,只表示硫酸的强氧化性,故C不选;
D.H2SO4+Na2SO3═Na2SO4+H2O+SO2↑强酸制弱酸,只表现硫酸的酸性,故D不选;
故选:A.
点评 本题考查了元素化合物知识,熟悉硫酸的强氧化性、酸性是解题关键,题目难度不大.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
8.常温下有体积相同的四种溶液:①pH=3的CH3COOH溶液 ②pH=3的盐酸 ③pH=11的氨水 ④pH=11的NaOH溶液.下列说法正确的是( )
| A. | 若将四种溶液稀释100倍,溶液pH大小顺序:③>④>①>② | |
| B. | ③和④分别用等浓度的硫酸溶液中和,消耗硫酸溶液的体积:③=④ | |
| C. | ①与②分别与足量镁粉反应,生成H2的量:①<② | |
| D. | ②和③混合,所得混合溶液的pH大于7 |
9.下列现象或事实能用同一原理解释的是( )
| A. | SO2和FeSO4溶液使酸性高锰酸钾的紫色退去 | |
| B. | Cl2和SO2都能使品红溶液褪色 | |
| C. | 常温下铁和金都不溶于浓硝酸 | |
| D. | 漂白粉和水玻璃长期暴露会变质 |
6.能用H++OH-═H2O来表示的化学反应是( )
| A. | NaOH溶液与醋酸反应 | B. | KOH溶液与稀盐酸反应 | ||
| C. | Ba(OH)2溶液与稀硫酸反应 | D. | Cu(OH)2与稀硝酸反应 |
13.某有机物分子式为C8H8O2,其中能与NaOH溶液反应且分子中含有苯环的同分异构体数目为( )
| A. | 9种 | B. | 16种 | C. | 20种 | D. | 29种 |
3.下列哪个选项属于碳链异构( )
| A. | (CH3)2=CHCH3和(CH3)2CHCH=CH2 | B. | CH2=C(CH3)2和CH3CH=CHCH3 | ||
| C. | CH3CH2CH2COOH 和CH3COOCH2CH2 | D. | CH3CH2OH和CH3OCH3 |
10.标准状况下,100mL稀硝酸与足量金属锌完全反应生成336mL N0和NO2,向混合气体中加入336mL NH3,在一定条件下恰好使其完全转化为N2.若用一定浓度的氢氧化钠溶液进行吸收处理(反应方程式:2NO2+2Na0H═NaNO3+NaNO2+H20;NO2+N0+2Na0H═2NaNO2+H20),则消耗氢氧化钠溶液的体积为150mL,下列说法正确的是( )
| A. | 混合气体中N0的物质的量为0.01mol | |
| B. | 混合气体中N02的物质的量为0.02mol | |
| C. | 稀硝酸的浓度为0.045mol/L | |
| D. | 氢氧化钠溶液的浓度为0.1mol/L |

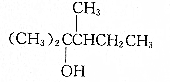


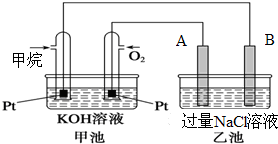 如图所示是甲烷燃料电池工作时的装置,乙池中的两个电极一个是石墨电极,一个是铜电极,工作时A、B两个电极的质量都不减少,请回答下列问题:
如图所示是甲烷燃料电池工作时的装置,乙池中的两个电极一个是石墨电极,一个是铜电极,工作时A、B两个电极的质量都不减少,请回答下列问题: