题目内容
2.下列物质露置在空气,质量会减轻的是( )| A. | NaOH | B. | Na2CO3 | C. | 无水CaCl2 | D. | Na2CO3•10H2O |
分析 A、氢氧化钠容易潮解,并吸收二氧化碳;
B、碳酸钠不变质,质量不变;
C、无水CaCl2吸水;
D、Na2CO3•10H2O容易风化.
解答 解:A、氢氧化钠易吸水潮解,并与二氧化碳反应而质量变大,故A错误;
B、碳酸钠不变质,质量不变,故B错误;
C、无水CaCl2吸水,质量增加,故C错误;
D、碳酸钠晶体在空气中易风化,失掉结晶水,质量减小,故D正确;
故选:D.
点评 本题考查钠的化合物的性质,是对常见物质特性的考查,关键是要知道这些物质在空气中发生了什么变化,难度不大.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
12.下列实验操作或处理方法正确的是( )
| A. | 分液时,分液漏斗中的两层液体均从下口放出 | |
| B. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| C. | 称量NaOH固体时,将NaOH固体放在托盘天平左盘的纸上 | |
| D. | 不慎将浓碱沾到皮肤上,应立即用大量水冲洗,然后涂上硼酸溶液 |
13.下列对有关实验事实的解释或得出的结论合理的是( )
| 选项 | 实验事实 | 解释或结论 |
| A | 被酸雨污染的农田及湖泊可撒石灰石粉末,减轻其危害 | 氧化钙可以与酸反应,生成盐和水 |
| B | 浓硫酸、浓盐酸暴露在空气中浓度降低 | 浓度降低原理相同 |
| C | 常温下,铁在浓硫酸中钝化 | 该过程体现了浓硫酸的强氧化性 |
| D | 向2SO2+O2?2SO3的平衡体系中,充入SO2,平衡正向移动 | V正增大,V逆减小,V正>V逆,所以平衡正向移动 |
| A. | A | B. | B | C. | C | D. | D |
17.下列有关焓变和反应热的说法正确的是( )
| A. | 反应热和焓变的单位都是kJ | |
| B. | 如果反应是在恒温恒压条件下进行的,此时的反应热与焓变相等 | |
| C. | 任何化学反应都存在活化能,且不可能接近于零 | |
| D. | 任何化学反应的反应热均可通过实验直接测定 |
7.下列有关实验的描述正确的是( )
| 选项 | 操作 | 实验目的 |
| A | 沿玻璃棒将蒸馏水缓慢倒入盛有浓硫酸的烧杯中,边加边搅拌 | 稀释浓硫酸 |
| B | 测定相同浓度的Na2SO4和Na2SiO3溶液的pH值 | 比较硫和硅的非金属性强弱 |
| C | 将铁的氧化物溶于过量稀盐酸中,再滴加几滴紫红色KMnO4溶液 | 判断某铁的氧化物是否含有Fe2+ |
| D | 用装有双氧水的碱式滴定管,采用淀粉溶液作为指示剂,滴定NaCl和NaI混合溶液 | 测定NaI的含量 |
| A. | A | B. | B | C. | C | D. | D |
14.下列装置及操作能达到实验目的是( )
| A. | 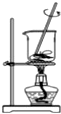 蒸发食盐水得到氯化钠晶体 | B. | 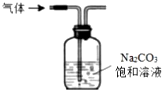 除去CO2中含有少量HCl气体 | ||
| C. | 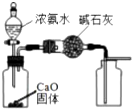 制取并收集干燥纯净的NH3 | D. |  验证SO2的还原性 |
11.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂.工业上先制得高铁酸钠,然后在低温下,在高铁酸铁的溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4).
湿法制备:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
干法制备:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法错误的是( )
湿法制备:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
干法制备:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法错误的是( )
| A. | 干法中生成的高铁酸钠既是氧化产物又是还原产物 | |
| B. | 湿法中每生成1mol Na2FeO4 转移3mol电子 | |
| C. | 干法中每生成1 mol Na2FeO4 转移4mol电子 | |
| D. | K2FeO4处理水时,不仅能消毒杀菌,生成的Fe(OH)3胶体还能吸附水中的悬浮杂质 |
12.将下列选项中的物质加人(或通入)氢硫酸溶液中,可使反应后溶液酸性最终增强的是( )
| A. | 氯气 | B. | 氢氧化钠 | C. | 硫酸钠 | D. | 二氧化硫 |