题目内容
MgSO4?7H2O可用于造纸、纺织、陶瓷、油漆工业,也可在医疗上用作泻盐.某工业废渣主要成分是MgCO3,另外还有CaCO3、SiO2等杂质.从此废渣中回收MgSO4?7H2O的工艺如下:已知CaSO4和MgO4的溶解度(S)随温度(T)变化曲线如图,试回答下列问题: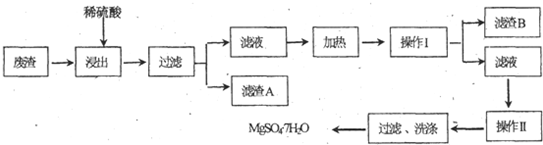
已知CaS04和MgS04的溶解度(S)随温度(T)变化曲线如图所示,

(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 (要求写出任意一条).
(2)滤渣B的主要成分的化学式是 .
(3)操作I的名称是 ,操作Ⅱ的名称是 .
(4)操作I和操作II都需要用到玻璃棒,作I中玻璃棒的主要作用是 ,操作Ⅱ中玻璃棒的主要作用是 .
(5)有人认为Mg2+易水解,经操作Ⅱ后再过滤、洗涤得不到MgSO4?7H2O晶体,你认为这种说法是否正确.(填“是”或“否”),原因是 .

已知CaS04和MgS04的溶解度(S)随温度(T)变化曲线如图所示,

(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有
(2)滤渣B的主要成分的化学式是
(3)操作I的名称是
(4)操作I和操作II都需要用到玻璃棒,作I中玻璃棒的主要作用是
(5)有人认为Mg2+易水解,经操作Ⅱ后再过滤、洗涤得不到MgSO4?7H2O晶体,你认为这种说法是否正确.(填“是”或“否”),原因是
考点:物质的分离、提纯的基本方法选择与应用,物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)加稀硫酸于废渣中,MgCO3、CaCO3溶解,根据溶解度-温度图,知道MgSO4随温度升高而溶解度增大;
(2)由工艺流程可知,废渣加入硫酸过滤,滤液中含有CaSO4、MgSO4,根据溶解度-温度图可知,CaSO4随温度升高而溶解度下降,MgSO4随温度升高而溶解度增大,滤液加热析出CaSO4;
(3)由工艺流程可知,操作Ⅰ是在加热的情况下将固体与溶液分离,操作Ⅱ是由溶液中析出晶体;
(4)操作Ⅰ是过滤,玻璃棒为引流作用;操作Ⅱ是结晶,玻璃棒为搅拌作用;
(5)MgS04水解生成氢氧化镁与硫酸,硫酸是非挥发性酸.
(2)由工艺流程可知,废渣加入硫酸过滤,滤液中含有CaSO4、MgSO4,根据溶解度-温度图可知,CaSO4随温度升高而溶解度下降,MgSO4随温度升高而溶解度增大,滤液加热析出CaSO4;
(3)由工艺流程可知,操作Ⅰ是在加热的情况下将固体与溶液分离,操作Ⅱ是由溶液中析出晶体;
(4)操作Ⅰ是过滤,玻璃棒为引流作用;操作Ⅱ是结晶,玻璃棒为搅拌作用;
(5)MgS04水解生成氢氧化镁与硫酸,硫酸是非挥发性酸.
解答:
解:(1)加稀硫酸于废渣中,MgCO3、CaCO3溶解,根据溶解度-温度图,知道MgSO4随温度升高而溶解度增大,“浸出”步骤中,为提高镁的浸出率,可采取的措施适当提高反应温度,同时不断搅拌,增加浸出时间,
故答案为:适当提高反应温度,同时不断搅拌,增加浸出时间;
(2)由工艺流程可知,废渣加入硫酸过滤,滤液中含有CaSO4、MgSO4,根据溶解度-温度图可知,CaSO4随温度升高而溶解度下降,MgSO4随温度升高而溶解度增大,滤液加热析出CaSO4,故操作Ⅰ在加热的情况下过滤,滤渣B是CaSO4.
故答案为:CaSO4;
(3)CaSO4随温度升高而溶解度下降,加热的情况下,可以降低CaSO4溶解度,操作Ⅰ在加热的情况下将固体与溶液分离,应是趁热过滤;操作Ⅱ是由溶液中析出晶体,应为蒸发浓缩、冷却结晶,
故答案为:趁热过滤;蒸发浓缩、冷却结晶;
(4)操作Ⅰ是过滤,玻璃棒为引流作用;操作Ⅱ是结晶,玻璃棒为搅拌作用,故答案为:引流;搅拌;
(5)MgS04水解生成氢氧化镁与硫酸,硫酸是难挥发性酸,最后生成的硫酸与氢氧化镁又生成硫酸镁.操作Ⅱ后过滤、洗涤可以得到MgS04?7H20晶体,
故答案为:否,硫酸是难挥发性酸.
故答案为:适当提高反应温度,同时不断搅拌,增加浸出时间;
(2)由工艺流程可知,废渣加入硫酸过滤,滤液中含有CaSO4、MgSO4,根据溶解度-温度图可知,CaSO4随温度升高而溶解度下降,MgSO4随温度升高而溶解度增大,滤液加热析出CaSO4,故操作Ⅰ在加热的情况下过滤,滤渣B是CaSO4.
故答案为:CaSO4;
(3)CaSO4随温度升高而溶解度下降,加热的情况下,可以降低CaSO4溶解度,操作Ⅰ在加热的情况下将固体与溶液分离,应是趁热过滤;操作Ⅱ是由溶液中析出晶体,应为蒸发浓缩、冷却结晶,
故答案为:趁热过滤;蒸发浓缩、冷却结晶;
(4)操作Ⅰ是过滤,玻璃棒为引流作用;操作Ⅱ是结晶,玻璃棒为搅拌作用,故答案为:引流;搅拌;
(5)MgS04水解生成氢氧化镁与硫酸,硫酸是难挥发性酸,最后生成的硫酸与氢氧化镁又生成硫酸镁.操作Ⅱ后过滤、洗涤可以得到MgS04?7H20晶体,
故答案为:否,硫酸是难挥发性酸.
点评:本题考查学生阅读题目获取信息能力、对工艺流程的理解、物质推断、物质分离提纯与条件控制等,综合性较强,题目难度中等,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力.

练习册系列答案
相关题目
新型陶瓷材料氮化硅(Si3N4)可以通过以下反应制得:3Si02+6C+2N2?Si3N4+6C0,下列就该反应的分析错误的是( )
| A、压强增大,平衡向逆反应方向移动 |
| B、Si02是氧化剂,CO是氧化产物 |
| C、上述反应若为放热反应,升高温度,平衡常数将减小 |
| D、上述反应中每生成1mol Si3N4,氮元素得12mol电子 |
短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,且X、Y、W原子最外层电子数之和恰好等于Z元素的核电荷数,X与W的最高化合价之和为8,常见金属元素Z的一种核素的质量数为28,中子数比质子数多2.下列说法中正确的是( )
| A、用“百度”搜索知,Y、Z形成的化合物“室温下强度高,….导热性好,热膨胀系数小,是良好的耐热冲击材料.”由此可推测该化合物属于离子晶体 |
| B、化合物YW3水解产物之一具有强氧化性,由此可知Y在该化合物中的化合价为+3 |
| C、由非金属元素组成的化合物YX5是一种是否存在尚待确证的化合物,假如存在,该物质与水反应必然生成气体X2,同时得到一种弱碱溶液 |
| D、因为Z的氧化物熔点很高,不适宜于电解,故工业上常用电解Z与W的化合物的方法制取单质Z |
实验室将9g铝粉跟一定量的金属氧化物粉末混合发生铝热反应,铝粉完全反应后,所得固体中含金属单质为l8g,则该氧化物粉末可能是下列中的( )
| A、Fe2O3和MnO2 |
| B、MnO2和V2O5 |
| C、Cr2O3和V2O5 |
| D、Fe2O3和CuO |
 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
