题目内容
11.将锌片和铜片用导线连接后放入稀硫酸溶液中,发生原电池反应,下列叙述错误的是( )| A. | 溶液的pH增大 | B. | 锌片的质量减轻 | ||
| C. | 溶液中的SO42-浓度增大 | D. | 溶液的密度增大 |
分析 锌片-铜片-稀硫酸溶液组成的原电池中,较活泼的金属锌作负极,铜作正极;负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应.
解答 解:A、原电池放电时,正极上氢离子得电子生成氢气析出,导致溶液中氢离子浓度降低,PH值增大,故A正确;
B、原电池放电时,负极上锌失电子生成锌离子进入溶液,导致锌片质量减轻,故B正确;
C、原电池放电时,负极上锌失电子生成锌离子进入溶液,正极上氢离子得电子生成氢气,所以该反应中硫酸根离子浓度基本不变,故C错误;
D、原电池放电时,溶液由硫酸溶液逐渐变成硫酸锌溶液,所以溶液的密度增大,故D正确.
故选C.
点评 本题考查了原电池原理,难度不大,明确正负极上发生的电极反应是解本题的关键.

练习册系列答案
相关题目
2.下列表示不正确的是( )
| A. | 1mol H2 | B. | 1molFe | C. | 1mol小米 | D. | 1mol NH3 |
19.已烯雌酚(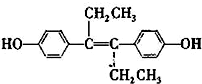 )是一种激素类药物,下列说法不正确的是( )
)是一种激素类药物,下列说法不正确的是( )
 )是一种激素类药物,下列说法不正确的是( )
)是一种激素类药物,下列说法不正确的是( )| A. | 已烯雌酚的分子式为C18H20O2,它为芳香族化合物 | |
| B. | 已烯雌酚分子中一定有16个碳原子共平面 | |
| C. | 1 mol已烯雌酚可以与5 mol Br2发生反应 | |
| D. | 已烯雌酚能发生加成、取代、氧化、加聚、酯化反应 |
16.关于有机物的下列说法正确的是( )
| A. | 葡萄糖分子式为C6H12O6,是一种己醛糖,它是最简单的醛糖 | |
| B. | 人造丝、人造棉、铜氨纤维、醋酸纤维的主要成分均为纤维素 | |
| C. | 红外光谱仪、核磁共振氢谱仪、质谱仪都可用于有机物的结构分析 | |
| D. | 蛋白质的二级结构主要依靠不同肽链间亚氨基上的H与羰基上的O形成氢键而实现的 |
3.在一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI(g)?H2(g)+I2(g),2s 时生成0.1mol H2,则表示该时段的化学反应速率正确的是( )
| A. | v(HI)=0.8 mol•Lˉ1•sˉ1 | B. | v(I2)=0.2 mol•Lˉ1•sˉ1 | ||
| C. | v(HI)=0.1 mol•Lˉ1•minˉ1 | D. | v(H2)=0.05 mol•Lˉ1•sˉ1 |
20.某微粒用${\;}_{Z}^{A}$Rn+表示,下列关于这种微粒的叙述正确的是( )
| A. | 所含质子数Z+A | B. | 所含电子数Z+n | C. | 所含中子数 A-Z | D. | 质量数Z |
16.中药狼把草的成分之一M具有消炎杀菌作用,M的结构如图所示,则叙述正确的是( )
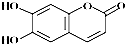

| A. | M的分子式为C9H8O4 | |
| B. | 1 mol M最多能与2 molBr2发生反应 | |
| C. | M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 | |
| D. | 1 mol M与足量NaHCO3反应能生成2 mol CO2 |