题目内容
8.常温下,下列各组离子在指定溶液中一定能大量共存的是( )| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、Na+、AlO2-、CO32- | |
| B. | 能溶解Al2O3的溶液:Na+、K+、HCO3-、NO3- | |
| C. | 饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| D. | 能使甲基橙显红色的溶液:K+、Fe2+、Cl-、NO3- |
分析 A.该溶液为碱性溶液,溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
B.能溶解Al2O3的溶液中存在大量氢离子或氢氧根离子,碳酸氢根离子与氢离子、氢氧根离子反应;
C.饱和氯水具有强氧化性,能够氧化亚硫酸根离子;
D.能使甲基橙显红色的溶液为酸性溶液,硝酸根离子在酸性条件下能够氧化亚铁离子.
解答 解:A.该溶液中存在大量氢氧根离子,K+、Na+、AlO2-、CO32-之间不发生反应,且都不与氢氧根离子反应,在溶液中能够大量共存,故A正确;
B.能溶解Al2O3的溶液为酸性或强碱性溶液,溶液中存在大量氢离子或氢氧根离子,HCO3-与氢离子和氢氧根离子反应,在溶液中一定不能大量共存,故B错误;
C.饱和氯水能够氧化SO32-,在溶液中不能大量共存,故C错误;
D.能使甲基橙显红色的溶液为酸性溶液,Fe2+、NO3-在酸性条件下能够发生氧化还原反应,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的正误判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
2.卤素单质的性质活泼,卤素的化合物应用广泛,运用化学反应原理研究卤族元素的有关性质具有重要意义.
(1)下列关于氯水的叙述正确的是AEF(填写序号).
A.氯水中存在两种电离平衡
B.向氯水中通入SO2,其漂白性增强
C.向氯水中通入氯气,$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小
D.加水稀释氯水,溶液中的所有离子浓度均减小
E.加水稀释氯水,水的电离平衡向正反应方向移动
F.向氯水中加少量固体NaOH,可能有c(Na+)=c(Cl-)+c(ClO-)
(2)常温下,已知25℃时有关弱酸的电离平衡常数:
写出84消毒液(主要成分为NaClO)露置在空气中发生反应的有关化学方程式NaClO+CO2+H2O═HClO+NaHCO3.若将84消毒液与洁厕剂(含有浓盐酸)混合使用可能会导致中毒,请用离子方程式解释有关原因ClO-+Cl-+2H+═Cl2↑+H2O.
(3)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.工业上制备ClO2的反应原理常采用:2NaClO3+4HCl(浓)═2ClO2↑+Cl2↑+2H2O+2NaCl.
①浓盐酸在反应中显示出来的性质是B(填序号).
A.只有还原性 B.还原性和酸性
C.只有氧化性 D.氧化性和酸性
②若上述反应中产生0.1mol ClO2,则转移电子的物质的量为0.1mol.
③ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果.现用ClO2将CN-氧化,有两种气体生成,其离子反应方程式为2ClO2+2CN-=N2↑+2CO2↑+2Cl-.
(1)下列关于氯水的叙述正确的是AEF(填写序号).
A.氯水中存在两种电离平衡
B.向氯水中通入SO2,其漂白性增强
C.向氯水中通入氯气,$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小
D.加水稀释氯水,溶液中的所有离子浓度均减小
E.加水稀释氯水,水的电离平衡向正反应方向移动
F.向氯水中加少量固体NaOH,可能有c(Na+)=c(Cl-)+c(ClO-)
(2)常温下,已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HClO | H2CO3 |
| 电离平衡常数 | K=3.0×10-8 | K1=4.4×10-7,K2=4.7×10-11 |
(3)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.工业上制备ClO2的反应原理常采用:2NaClO3+4HCl(浓)═2ClO2↑+Cl2↑+2H2O+2NaCl.
①浓盐酸在反应中显示出来的性质是B(填序号).
A.只有还原性 B.还原性和酸性
C.只有氧化性 D.氧化性和酸性
②若上述反应中产生0.1mol ClO2,则转移电子的物质的量为0.1mol.
③ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果.现用ClO2将CN-氧化,有两种气体生成,其离子反应方程式为2ClO2+2CN-=N2↑+2CO2↑+2Cl-.
19.下列有关说法正确的是( )
| A. | 在任何条件下,纯水都呈中性 | |
| B. | 电离平衡常数Ka越小,表示弱电解质电离能力越强 | |
| C. | 为保存FeCl3溶液,要在溶液中加少量硫酸 | |
| D. | 明矾溶液蒸干得到的固体为Al(OH)3 |
16.pH=12的NaOH溶液和pH=10的NaOH溶液等体积混合后溶液的( )
| A. | pH=11 | B. | pH=10.3 | ||
| C. | c(H+)=2×10-12 mol•L-1 | D. | c(H+)=(10-12+10-10)/2 mol•L-1 |
3.室温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| B. | c(H+)=1.0×10-13mol/L溶液中:S2-、K+、SO32-、Br- | |
| C. | Na2S溶液中:SO42-、K+、Cl-、Al3+ | |
| D. | pH=12的溶液中:NO3-、I-、Na+、Al3+ |
13.下列说法正确的是( )
| A. | 有机物CH3C(CH3)3的系统命名为2,2-二甲基新戊烷 | |
| B. | 樱桃是一种抗氧化的水果,樱桃中含有一种羟基酸,如图所示 ,通常条件下,该羟基酸可以发生取代、氧化和加成反应 ,通常条件下,该羟基酸可以发生取代、氧化和加成反应 | |
| C. | 涤纶是由对苯二甲酸(PTA)和乙二醇(EG)通过加聚反应得到的 | |
| D. | 等质量的甲醛和乙酸充分燃烧耗氧量相同 |
20.下列叙述中,正确的是( )
| A. | 在标准状况下,1mol任何物质的体积为22.4L | |
| B. | 等物质的量的HCl和 H 2 SO4中,H+的物质的量也相等 | |
| C. | 1molH 2和1molHe中,所含的分子数相同、原子数相同、质量也相同 | |
| D. | 体积为6L的 O 2,其质量可能为8g |
17.如图所示的甲、乙两个装置中(常温),胶头滴管中吸入某种液体,圆底烧瓶中充入(或放入)另一种物质,挤压胶头滴管中液体,一段时间后两装置中的气球都有明显地胀大(忽略液体体积对气球的影响).则下列选项中所用试剂合理的是( )
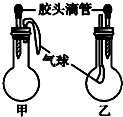
| 选项 | 甲 | 乙 | ||
| 滴管中 | 烧瓶中 | 滴管中 | 烧瓶中 | |
| A | 水 | 钠 | 饱和碳酸钠溶液 | CO2 |
| B | 水 | 过氧化钠 | 饱和碳酸氢钠溶液 | CO2 |
| C | NaOH溶液 | 碳酸氢钠 | 澄清石灰水 | 碳酸氢钠 |
| D | 稀盐酸 | 碳酸氢钠 | FeCl3溶液 | Cu |

| A. | A | B. | B | C. | C | D. | D |
18.下列关于氯水的叙述正确的是( )
| A. | 新制氯水中只含Cl2和H2O | |
| B. | 将镁粉加入新制氯水中无明显变化 | |
| C. | 氯水放置一段时间后颜色将变深 | |
| D. | 新制氯水可使紫色石蕊试液先变红后褪色 |