题目内容
11.下列文字表述与反应方程式对应且正确的是( )| A. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | |
| B. | 实验室一般用纯水和电石制乙炔:CaC2+2H2O═C2H2↑+Ca(OH)2 | |
| C. | 甲苯与浓硝酸和浓硫酸的混合物反应: | |
| D. | 实验室用液溴和苯制溴苯: |
分析 A.溴乙烷为非电解质,不能电离出溴离子;
B.电石和水反应剧烈,产生大量泡沫堵塞导气管,一般用饱和食盐水;
C.硝基中氮原子和苯环上的碳原子间形成共价键;
D.苯与溴在三价铁离子催化剂条件下生成溴苯和溴化氢.
解答 解:A.溴乙烷为非电解质,不能电离产生溴离子,与硝酸银不反应,故A错误;
B.电石和水反应剧烈,产生大量泡沫堵塞导气管,实验室一般用饱和食盐水和电石制乙炔:CaC2+2H2O→C2H2↑+Ca(OH)2 ,故B错误;
C.甲苯与浓硝酸和浓硫酸的混合物反应,硝基中氮原子和苯环上的碳原子间形成共价键,反应的化学方程式: ,故C错误;
,故C错误;
D.实验室用液溴和苯在催化剂作用下制溴苯: ,故D正确;
,故D正确;
故选D.
点评 本题考查了化学方程式的书写,明确有机物结构特点是解题关键,题目难度不大,注意反应的条件和结构的理解.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.铅酸蓄电池是目前应用普遍的化学电池,新型液流式铅酸蓄电池以可溶的甲基磺酸铅为电解质,电池总反应:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O.下列有关铅酸蓄电池的说法正确的是( )
| A. | 充放电时,溶液的导电能力变化不大 | |
| B. | 电解稀硫酸可能发生的反应是:Cu+H2SO4 $\frac{\underline{\;电解\;}}{\;}$ CuSO4+H2↑ | |
| C. | 充电时,铅酸蓄电池的阴极与外接电源的正极相连 | |
| D. | 充电时的阳极反应式为:Pb+4OH-+2e-═PbO2+2H2O |
19.下列离子方程式书写正确的是( )
| A. | Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO${\;}_{3}^{-}$+OH-+Ca2+═CaCO3↓+H2O | |
| C. | C6H5ONa溶液中通入少量CO2:2C6H5O-+CO2+H2O-→2C6H5OH+CO${\;}_{3}^{2-}$ | |
| D. | 用惰性电极电解MgCl2溶液:2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- |
6.下列有机物的系统命名错误的是( )
| A. | 2-甲基-2,4-己二烯 | B. | 4-甲基-1-戊炔 | ||
| C. | 2-甲基-6-乙基庚烷 | D. | 1,3,5-三甲苯 |
16.向一定量的AlCl3 溶液中逐滴加入NaOH溶液,生成沉淀Al(OH)3的量随NaOH加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
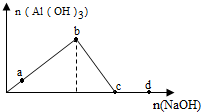

| A. | a点对应的溶液中:K+、NH4+、I-、CO32- | |
| B. | b点对应的溶液中:Na+、H+、S2-、Cl- | |
| C. | c点对应的溶液中:NH4+、H+、NO3-、SO42- | |
| D. | d点对应的溶液中:Na+、K+、SO42-、HCO3- |
1.下列说法中正确的是( )
| A. | 金属铜在物质分类中属于单质,所以它既不是电解质也不是非电解质 | |
| B. | 强电解质水溶液的导电性一定比弱电解质水溶液的导电性强 | |
| C. | 用硫化亚铁除去污水中的铜离子,是利用硫化亚铁比硫化铜在水中更难溶 | |
| D. | 对于已经达到平衡的化学反应,改变压强,平衡常数(K)可能改变 |

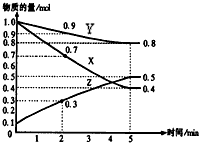 在某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图所示.
在某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图所示.