题目内容
8.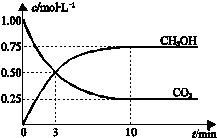 已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )| A. | 升高温度能使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大 | |
| B. | 反应达到平衡状态时,CO2的平衡转化率为75% | |
| C. | 3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 | |
| D. | 从反应开始到平衡,H2的平均反应速率υ(H2)=0.075mol/(L.min) |
分析 A、根据温度对该化学反应平衡的影响判断移动方向,从而判断甲醇和二氧化碳的物质的量比值的变化;
B、根据反应达到平衡状态时,二氧化碳反应的物质的量与二氧化碳的初始物质的量的比值就是其转化率;
C、3 min时,CH3OH和CO2的浓度相等,但反应没有达到平衡状态;
D、根据v=$\frac{△C}{△t}$计算其平均反应速率.
解答 解:A、此反应是放热反应,升高温度,平衡左移,导致甲醇的物质的量减少,二氧化碳的物质的量增大,所以使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$减小,故A错误;
B、反应达到平衡状态时,二氧化碳减少的物质的量浓度为(1.00-0.25)mol/L,所以其转化率=$\frac{(1.00-0.25)mol/L}{1.00mol/L}$=75%,故B正确;
C、3 min时,CH3OH和CO2的浓度相等,但是并没有达到平衡,所以速率不相等,故C错误;
D、从反应开始到平衡,二氧化碳的平均反应速率=$\frac{(1.00-0.25)mol/L}{10min}$=0.075 mol•L-1•min-1,H2的平均反应速率υ(H2)=0.225mol•L-1•min-1,故D错误.
故选B.
点评 本题考查了图象分析题,难度不大,注意转化率的计算方法、外界条件对化学平衡的影响、化学反应速率的计算等问题.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.已知有反应BrO${\;}_{3}^{-}$+5Br-+6H+═3Br2+3H2O.下列反应中从反应原理来看与该反应最相似的是( )
| A. | 2KNO3═2KNO2+O2↑ | B. | NH4HCO3═NH3↑+CO2↑+H2O | ||
| C. | 3NO2+H2O═2HNO3+NO | D. | SO2+2H2S═3S↓+2H2O |
17.下列物质的水溶液能导电,但属于非电解质的是( )
| A. | HNO3 | B. | Cl2 | C. | SO2 | D. | NH4NO3 |


 ;中间产品C中混有反应物A和B,检验C中含有A的试剂是NaHCO3溶液.
;中间产品C中混有反应物A和B,检验C中含有A的试剂是NaHCO3溶液. .
. .
.