题目内容
12.在25℃时,用石墨电极电解2.0L1.5mol/LCuSO4溶液.5min后,在一个石墨电极上有9.6g Cu生成.试回答下列问题:(1)阳极电极反应式为4OH--4e-=O2↑+2H2O.
(2)反应过程中有0.3mol电子发生转移,得到O2的体积(标准状况)是1.68L,反应后溶液中的H+物质的量浓度是0.3mol/L(假设溶液体积不变).
分析 (1)阳极发生氧化反应,电极反应式为4OH--4e-=O2↑+2H2O;
(2)根据阴极反应:Cu2++2e-═Cu,当有9.6g Cu即0.15mol生成时,反应所转移的电子的物质的量是0.3mol,得到氧气的体积为:$\frac{0.3}{4}×22.4$=1.68L,根据电解池的电解原理方程式计算产生硫酸的量,计算氢离子浓度.
解答 解:(1)阳极发生氧化反应,电极反应式为4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
(2)根据阴极反应:Cu2++2e-═Cu,当有9.6g Cu即0.15mol生成时,反应所转移的电子的物质的量是0.3mol,得到氧气的体积为:$\frac{0.3}{4}×22.4$=1.68L,
电解原理方程式为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,生成0.15mol铜的同时,产生硫酸的物质的量是0.15mol,所以$\frac{0.15×2}{2}$=0.3mol/L,故答案为:0.3;1.68;0.3mol/L.
点评 本题考查学生电解原理的有关知识,可以根据所学知识来回答,注意电子守恒的应用,难度不大.

练习册系列答案
相关题目
2.下列有关说法,不正确的是( )
①将盛有二氧化氮气体的试管倒立在水中,溶液会充满试管
②向煤中加入适量石灰石,在煤燃烧时最终生成CaSO4,可减少SO2对大气的污染
③为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
④电解从海水中得到的氯化镁溶液可获得金属镁
⑤为证明NaHCO3溶液中混有Na2CO3,取少量溶液,加入澄清石灰水,若有白色沉淀生成,则证明混有Na2CO3
⑥用FeCl3溶液腐蚀铜制印刷电路板:2Fe3++Cu=2Fe2++Cu2+.
①将盛有二氧化氮气体的试管倒立在水中,溶液会充满试管
②向煤中加入适量石灰石,在煤燃烧时最终生成CaSO4,可减少SO2对大气的污染
③为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
④电解从海水中得到的氯化镁溶液可获得金属镁
⑤为证明NaHCO3溶液中混有Na2CO3,取少量溶液,加入澄清石灰水,若有白色沉淀生成,则证明混有Na2CO3
⑥用FeCl3溶液腐蚀铜制印刷电路板:2Fe3++Cu=2Fe2++Cu2+.
| A. | 仅①③④⑤ | B. | 仅②③④ | C. | 仅①③④ | D. | 仅①②④⑤ |
3.下列关于卤代烃的说法正确的是( )
| A. | 在卤代烃中,卤素原子与碳原子间形成共价键 | |
| B. | 在溴乙烷(CH3CH2Br)分子中,溴元素的存在形式为溴离子 | |
| C. | 聚四氟乙烯(塑料王)为高分子化合物,不属于卤代烃 | |
| D. | 卤代烃的沸点比相应烷烃的沸点低 |
4.已知有如下反应:
①2BrO3-+Cl2═Br2+2ClO3-
②ClO3-+5Cl-+6H+═3Cl2+3H2O
③2FeCl2+Cl2═2FeCl3
④2FeCl3+2KI═2FeCl2+2KCl+I2
下列各微粒氧化能力由强到弱的顺序正确的是( )
①2BrO3-+Cl2═Br2+2ClO3-
②ClO3-+5Cl-+6H+═3Cl2+3H2O
③2FeCl2+Cl2═2FeCl3
④2FeCl3+2KI═2FeCl2+2KCl+I2
下列各微粒氧化能力由强到弱的顺序正确的是( )
| A. | ClO3->BrO3->Cl2>Fe3+>I2 | B. | BrO3->Cl2>ClO3->I2>Fe3+ | ||
| C. | BrO3->ClO3->Cl2>Fe3+>I2 | D. | BrO3->ClO3->Fe3+>Cl2>I2 |
1.下列有关同分异构体的叙述正确的是( )
| A. | CH3CH2CH=CHCH2CH3不存在顺反异构体 | |
| B. | 分子式为C5H10O2的羧酸有8种 | |
| C. | 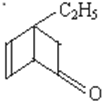 的属于芳香族化合物的同分异构体中不与金属钠反应的有5种 的属于芳香族化合物的同分异构体中不与金属钠反应的有5种 | |
| D. | 棱晶烷  为正三棱柱形,它的二氯代物有5种 为正三棱柱形,它的二氯代物有5种 |
2.将HCl和NaCl分别溶于水.下列说法正确的是( )
| A. | HCl的离子键被破坏 | B. | NaCl的共价键被破坏 | ||
| C. | HCl和NaCl的化学键均遭破坏 | D. | HCl和NaCl的化学键均未遭破坏 |
 二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.
二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.
 .
.