题目内容
16.有关化学键的断裂和形成,下列说法正确的是( )| A. | 氢气在氧气中燃烧时,存在化学键的断裂和形成 | |
| B. | 有化学键断裂的过程一定是化学变化 | |
| C. | 化学反应过程中,所有反应物中都要断裂化学键 | |
| D. | 干冰升华时,分子中的共价键发生断裂 |
分析 A.化学反应的实质是旧化学键的断裂和新化学键的形成;
B.有化学键断裂的过程不一定是化学变化;
C.化学反应过程中不一定是有反应物都要断裂化学键;
D.干冰升华时,化学键不被破坏,分子间作用力被破坏.
解答 解:A.化学反应的实质是旧化学键的断裂和新化学键的形成,氢气在氧气中燃烧发生化学变化,所以存在化学键的断裂和形成,故A正确;
B.有化学键断裂的过程不一定是化学变化,如电解质溶于水时只有化学键断裂,没有化学键形成,故B错误;
C.化学反应过程中不一定是有反应物都要断裂化学键,如氨气和氯化氢反应生成氯化铵,氨气中没有化学键断裂,故C错误;
D.干冰升华时,化学键不被破坏,分子间作用力被破坏,干冰升华是物理变化,故D错误;
故选A.
点评 本题考查化学键与化学反应的关系,为高频考点,明确化学反应实质、化学键内涵是解本题关键,易错选项是B,注意采用举例法分析解答,题目难度不大.

练习册系列答案
相关题目
17.用pH大小表示溶液的酸碱性相对强弱有许多不足之处,因此,荷兰科学家Hcnk Van Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH-)比值的对数,酸度的计算公式表示为AG=lg[c(H+)/c(OH-)],常温下,在AG=1的溶液中能大量共存的离子是( )
| A. | Ca2+、K+、Cl-、NO3- | B. | NH4+、Fe3+、I-、SO42- | ||
| C. | Na+、K+、ClO-、S2- | D. | Na+、S2O32-、AlO2-、K+ |
11. 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
(1)Y原子核外共有7种不同运动状态的电子,基态T原子有7种不同能级的电子.
(2)X、Y、Z的第一电离能由小到大的顺序为C<O<N(用元素符号表示).
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为sp杂化.
(4)Z与R能形成化合物甲,1mol甲中含4 mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为SiF4为正四面体形、H2O为V形.
(5)G、Q、R氟化物的熔点如表,造成熔点差异的原因为NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小、电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高.
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
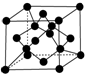
(7)X单质的晶胞如图所示,一个X晶胞中有8个X原子;若X晶体的密度为ρ g•cm-3,阿伏加德罗常数的值为NA,则晶体中最近的两个X原子之间的距离为$\frac{\sqrt{3}}{4}×\root{3}{\frac{96}{ρ{N}_{A}}}$ cm(用代数式表示).
 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.(1)Y原子核外共有7种不同运动状态的电子,基态T原子有7种不同能级的电子.
(2)X、Y、Z的第一电离能由小到大的顺序为C<O<N(用元素符号表示).
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为sp杂化.
(4)Z与R能形成化合物甲,1mol甲中含4 mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为SiF4为正四面体形、H2O为V形.
(5)G、Q、R氟化物的熔点如表,造成熔点差异的原因为NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小、电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高.
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1 539 | 183 |
(7)X单质的晶胞如图所示,一个X晶胞中有8个X原子;若X晶体的密度为ρ g•cm-3,阿伏加德罗常数的值为NA,则晶体中最近的两个X原子之间的距离为$\frac{\sqrt{3}}{4}×\root{3}{\frac{96}{ρ{N}_{A}}}$ cm(用代数式表示).
1.下列叙述不正确的是( )
| A. | 从100mL1.0mol•L-1的NaOH溶液中取出10mL该溶液,其溶液浓度仍为1.0mol•L-1 | |
| B. | 分离酒精和水可以采用分液的方法 | |
| C. | 在蒸发NaCl溶液时,等蒸发至少量液体时,停止加热,利用余热继续蒸干 | |
| D. | 在盛有碘水的试管中加入少量的CCl4后,充分振荡后下层颜色变为紫色 |
8.下列物质在氧气中燃烧只生成CO2和H2O的是( )
| A. | 烷烃 | B. | 卤代烃 | C. | 蛋白质 | D. | 橡胶 |
5.向某密闭容器中充入1mol CO和2mol H2O(g),发生反应:CO+H2O(g) $?_{高温}^{催化剂}$CO2+H2,当反应达到平衡时,CO的体积分数为x,若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
| A. | 0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2 | |
| B. | 1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2 | |
| C. | 0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2 | |
| D. | 0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2 |
6.碱金属具有特征的性质是( )
| A. | 具有银白色金属光泽 | B. | 良好的导热性 | ||
| C. | 较强的还原性 | D. | 优良的导电性 |
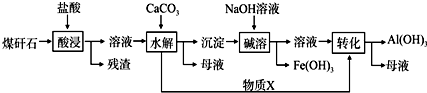
 .该工艺设计中,过量X参与反应的离子方程式是:AlO2-+CO2+2H2O=Al(OH)3+HCO3-.
.该工艺设计中,过量X参与反应的离子方程式是:AlO2-+CO2+2H2O=Al(OH)3+HCO3-.