题目内容
 如图中的实验装置可用于制取乙炔.请填空:
如图中的实验装置可用于制取乙炔.请填空:(1)制取乙炔的化学方程式是
(2)乙炔通入酸性KmnO4溶液中观察到的现象是
(3)乙炔通入溴的CCl4溶液中观察到的现象是
(4)乙炔与H2完全加成的化学方程式
考点:实验装置综合
专题:实验题
分析:图示装置可通过调节A管的高度,控制反应的发生和停止:将A管提高,右管中水面上升,与电石接触发生反应;将A管降低,右管中水面下降,水与电石脱离接触,反应停止,则制取乙炔的化学反应方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑,乙炔含有C≡C键,可发生加成、加聚和氧化反应,以此解答该题.
解答:
解:(1)制取乙炔的化学反应方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑,故答案为:CaC2+2H2O→HC≡CH↑+Ca(OH)2;
(2)乙炔容易被高锰酸钾氧化,使高锰酸钾褪色,故答案为:酸性KMnO4溶液褪色; 氧化;
(3)乙炔能够和溴的CCl4溶液发生加成反应,溶液褪色,故答案为:溴的CCl4溶液褪色;加成;
(4)乙炔含有C≡C键,可发生加成生成乙烷,反应的方程式为CH≡CH+2H2
CH2CH3,故答案为:CH≡CH+2H2
CH2CH3.
(2)乙炔容易被高锰酸钾氧化,使高锰酸钾褪色,故答案为:酸性KMnO4溶液褪色; 氧化;
(3)乙炔能够和溴的CCl4溶液发生加成反应,溶液褪色,故答案为:溴的CCl4溶液褪色;加成;
(4)乙炔含有C≡C键,可发生加成生成乙烷,反应的方程式为CH≡CH+2H2
| 催化剂 |
| △ |
| 催化剂 |
| △ |
点评:本题考查乙炔的实验室制法及其性质,侧重基础知识的考查,有利于培养学生的分析能力和实验能力,注意相关基础知识的积累,难度中等.

练习册系列答案
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn+2MnO2+H2O=Zn(OH)2+Mn2O3,下列说法错误的是( )
| A、电池工作时,锌失去电子 |
| B、电池正极的电极反应式为:2MnO2+H2O+2e-=Mn2O3+2OH- |
| C、电池工作时,OH-向MnO2反应的方向移动 |
| D、外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
对食物的酸、碱性判断正确的是( )
| A、西瓜是酸性食物 |
| B、猪肉、牛肉是碱性食物 |
| C、柠檬、橙是酸性食物 |
| D、苹果是碱性食物 |
 A、B、C、D、E为5种短周期元素,相对位置如图:
A、B、C、D、E为5种短周期元素,相对位置如图: 如图是制取无水氯化铜(易潮解)的实验装置图,A中装有MnO2,从B中滴入浓盐酸,E为石英玻璃管,内装细铜粉,F中装有碱石灰(生石灰和氢氧化钠)固体.请回答下列问题:
如图是制取无水氯化铜(易潮解)的实验装置图,A中装有MnO2,从B中滴入浓盐酸,E为石英玻璃管,内装细铜粉,F中装有碱石灰(生石灰和氢氧化钠)固体.请回答下列问题: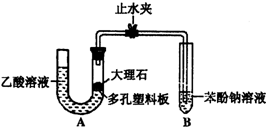 某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.
某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.