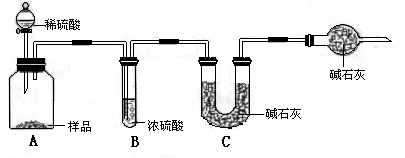
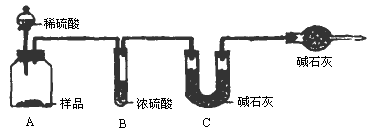
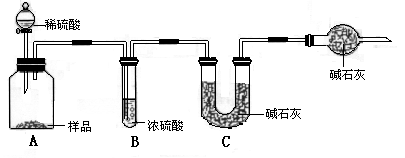
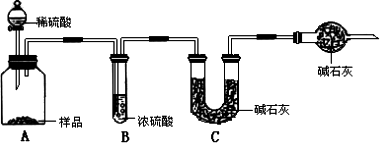
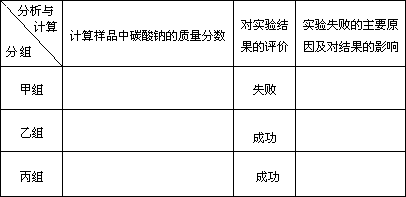
题目内容
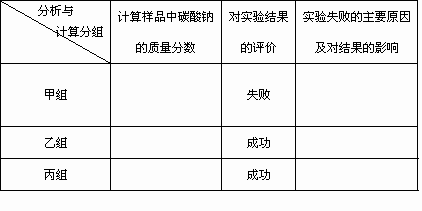
| |||||||||||
解析:
(1) |
碳酸氢钠时从含有大量NH4+、Na+、Cl-、HCO3-的饱和溶液中析出的,所以碳酸氢钠晶体中混有氯化钠杂质,又由于氯化钠受热不分解,导致工业纯碱中含有少量的氯化钠 |
(2) |
|

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案下图是某工厂对海水资源进行综合利用的示意图.
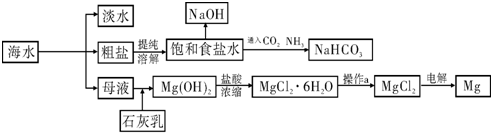
请回答下列问题:
(1)请列举一种海水淡化的方法
(2)工业上常用离子交换膜电解槽生产NaOH,电解过程中大量通过离子交换膜的离子是
(3)侯氏制碱法中首先向饱和食盐水中通入CO2和NH3制得NaHCO3,先通入
(填化学式),理由是
(4)镁是一种用途很广泛的金属材料,目前世界上60%的镁从海水中提取.已知有关物质的熔沸点数据如下:
| MgO | MgCl2 | |
| 熔点/℃ | 2852 | 714 |
| 沸点/℃ | 3600 | 1412 |
| |||||||||||