题目内容
下列结论正确的是( )
| A.离子的还原性:S2->Cl->Br->I- |
| B.酸性:H2SO4>HClO4>H2SeO4 |
| C.氧化性:Cl2>S>Se>Te |
| D.微粒半径:S2->Cl>S>F |
A、单质的氧化性:Cl2>Br2>I2>S,故离子的还原性顺序为:S2->I->Br->Cl-,故A错误;
B、原子的得电子能力越强,其最高价氧化物对应的水化物的酸的酸性就越强,得电子能力:Cl>S>Se,故酸性:HClO4>H2SO4>H2SeO4,故B错误;
C、同周期从左到右单质的氧化性逐渐增强,所以Cl2>S,同主族从上到下单质的氧化性逐渐减弱,S>Se>Te,故C正确;
D、电子层越多半径越大,所以S>F,同周期从左到右原子半径逐渐减小,所以Cl<S,故D错误.
故选C.
B、原子的得电子能力越强,其最高价氧化物对应的水化物的酸的酸性就越强,得电子能力:Cl>S>Se,故酸性:HClO4>H2SO4>H2SeO4,故B错误;
C、同周期从左到右单质的氧化性逐渐增强,所以Cl2>S,同主族从上到下单质的氧化性逐渐减弱,S>Se>Te,故C正确;
D、电子层越多半径越大,所以S>F,同周期从左到右原子半径逐渐减小,所以Cl<S,故D错误.
故选C.

练习册系列答案
相关题目
己知:2C(s)+O2(g)═2CO(g)△H=-221.0kJ?mol-1
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ?mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
下列结论正确的是( )
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ?mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
下列结论正确的是( )
| A、H2的燃烧热△H=-241.8kJ?mol-1 | B、炭和和水蒸气转化为水煤气为放热反应 | C、将24g 炭完全转化为水煤气,再充分燃烧,整个过程反应热为-787.0kJ?mol-1 | D、1mol H2O(g)完全分解需要吸收241.8kJ热量 |
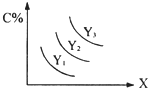 对于反应A(s)+2B(g?3C(g);△H>0,C%跟外界条件X、Y的关系如图所示,下列结论正确的是( )
对于反应A(s)+2B(g?3C(g);△H>0,C%跟外界条件X、Y的关系如图所示,下列结论正确的是( )| A、Y表示温度,X表示压强,且Y3>Y2>Y1 | B、Y表示压强,X表示温度,且Y3>Y2>Y1 | C、X表示压强,Y表示温度,且Y1>Y2>Y3 | D、X表示温度,Y表示压强,且Y1>Y2>Y3 |