题目内容
13.试判断112号元素应位于周期表中的( )| A. | 第七周期ⅣA族 | B. | 第七周期ⅡA族 | C. | 第七周期ⅡB族 | D. | 第六周期ⅥA族 |
分析 熟记稀有气体也就是0族元素的质子数(或碱金属族元素的质子数),这些元素分别是每个周期最后(或开始)一种元素,He-2,Ne-10,Ar-18,Kr-36,Xe-54,Rn-86,第七周期稀有气体原子序数=86+32=118,再根据原子序数之间的差值确定.
解答 解:该元素的原子序数为112,第七周期、ⅤⅡA族元素的原子序数为117,依此类推该元素在周期表中的位置为第七周期,第ⅡB族,故选C.
点评 本题考查元素的位置,为高频考点,把握稀有气体的原子序数及元素的原子序数与位置的关系为解答的关键,可以根据原子核外电子排布确定在周期表中的位置,题目难度不大.

练习册系列答案
相关题目
20.根据下列实验操作及现象,所得结论正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 向10mL 1mol/LNaOH溶液中先加入3滴1mol/LMgCl2溶液,再加入3滴1mol/LFeCl3溶液 | 现有白色沉淀,后为红褐色沉淀 | Mg(OH)2转化为Fe(OH)3 |
| B | 向某氯化亚铁溶液中,加入Na2O2粉末 | 出现红褐色沉淀 | 说明原氯化亚铁已氧化变质 |
| C | 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 | 有白色沉淀生成 | 溶液X中一定含有CO32-或HCO3- |
| D | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液 | 前者为黄色沉淀,后者为红褐色液体 | 温度升高,Fe3+的水解程度增大 |
| A. | A | B. | B | C. | C | D. | D |
1.关于工业生产的下列叙述中,不正确的是( )
| A. | 工业生产硫酸时,使用热交换器可以充分利用反应中所放出的热量 | |
| B. | 工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的 | |
| C. | 工业上用离子交换膜法电解饱和食盐水制烧碱 | |
| D. | 工业上采用电解(省电能30%)的AlCl3-KCl熔融体的方法制取金属铝 |
18.如表所示,提纯下列物质(括号内为杂质),所用除杂试剂和分离方法都正确的是( )
| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4(C2H4) | 酸性KMnO4溶液 | 洗气 |
| B | 苯(苯酚) | 溴水 | 过滤 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 苯(苯酚) | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
2.元素性质呈周期性变化的决定因素是( )
| A. | 元素相对原子质量依次递增 | |
| B. | 元素原子半径呈周期性变化 | |
| C. | 元素原子核外电子排布呈周期性变化 | |
| D. | 元素金属性或非金属性呈周期性变化 |
3.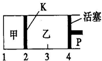 一定温度下可逆反应A(s)+2B(g)?2C(g)+D(g)△H<0.现将1molA和2molB加入甲容器中,将4molC和2molD加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动).下列说法正确的是( )
一定温度下可逆反应A(s)+2B(g)?2C(g)+D(g)△H<0.现将1molA和2molB加入甲容器中,将4molC和2molD加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动).下列说法正确的是( )
 一定温度下可逆反应A(s)+2B(g)?2C(g)+D(g)△H<0.现将1molA和2molB加入甲容器中,将4molC和2molD加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动).下列说法正确的是( )
一定温度下可逆反应A(s)+2B(g)?2C(g)+D(g)△H<0.现将1molA和2molB加入甲容器中,将4molC和2molD加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动).下列说法正确的是( )| A. | 保持温度和活塞位置不变,在甲中再加入1mol A和2mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持温度和乙中的压强不变,分别向甲、乙中加入等质量的氦气后,甲中平衡不移动,乙中平衡向正反应方向移动 | |
| C. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均减小 | |
| D. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
 某校课外活动小组为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示(加热装置和固定装置均已略去).图中K为止水夹(处于关闭状态),F是一半空的注射器.
某校课外活动小组为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示(加热装置和固定装置均已略去).图中K为止水夹(处于关闭状态),F是一半空的注射器.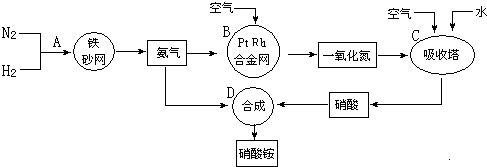
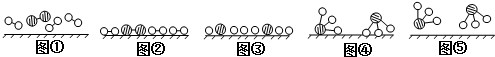
 、
、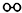 、
、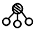 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.