题目内容
16.在氯氧化法处理含CN一的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐再进一步被氧化为无毒物质.(1)某厂废水中含KCN,其浓度为650mg•L-1.现用氯氧化法处理,发生如下反应:
KCN+2KOH+Cl2═KOCN+2KCl+H2O
再投入过量液氯,可将氰酸盐进一步氯化为氮气.请配平下列化学方程式:
2 KOCN+4 KOH+3Cl2═2 CO2+1 N2+6 KCl+2H2O
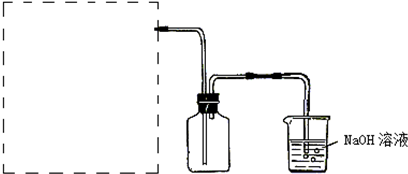
(2)实验室用MnO2与浓HCl制取Cl2,在答卷上画出虚线框内制取Cl2的装置图,并标出实验药品.
分析 (1)反应中KOCN→N2,N元素化合价由-3价升高为0价,共升高6价,Cl2→KCl,Cl元素化合价由0价降低为-1价,共降低2价,化合价升降最小公倍数为6,故N2系数为1,Cl2系数为3,结合原子守恒配平其它物质的系数;
(2)实验室是用二氧化锰和浓盐酸反应制氯气,是固体和液体加热制取气体的装置.
解答 解:(1)反应中KOCN→N2,N元素化合价由-3价升高为0价,共升高6价,Cl2→KCl,Cl元素化合价由0价降低为-1价,共降低2价,化合价升降最小公倍数为6,故N2系数为1,Cl2系数为3,结合原子守恒配平其它物质的系数,平衡后方程式为:2KOCN+4KOH+3Cl2═2CO2+N2+6KCl+2H2O,
故答案为:2、4、3、2、1、6、2;
(2)实验室是用二氧化锰和浓盐酸反应制氯气,是固体和液体加热制取气体的装置,反应装置如图 ,故答案为:
,故答案为: .
.
点评 本题考查了氧化还原反应方程式配平以及氯气的实验室制取原理,题目难度不大.

练习册系列答案
相关题目
7.关于醋酸溶液下列叙述错误的是( )
| A. | 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) | |
| B. | 升高温度,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$比值增大 | |
| C. | CH3COOH溶液中加少量的CH3COONa固体,醋酸的电离平衡逆向移动 | |
| D. | 0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 |
8.亚运期间,一些易燃、易爆、剧毒品、易腐蚀品等,严禁旅客带上车.下列化学药品,不允许旅客带上车的有
①浓硫酸②氰化钾③水银④TNT炸药⑤汽油⑥白磷( )
①浓硫酸②氰化钾③水银④TNT炸药⑤汽油⑥白磷( )
| A. | 只有①②④⑤⑥ | B. | 只有①②③④ | C. | 只有①②④ | D. | 都不行 |
 ①2,3一二甲基戊烷;
①2,3一二甲基戊烷; ②4-甲基-2-戊烯.
②4-甲基-2-戊烯.