题目内容
10.为测定某有机化合物A的结构,进行如下实验: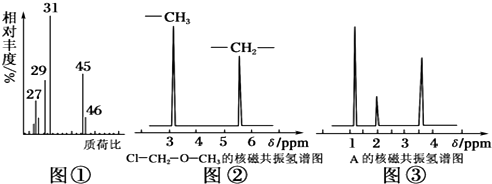
(一)分子式的确定:
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,消耗氧气6.72L(标准状况下),则该物质的实验式是C2H6O.
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图①所示质谱图,则其相对分子质量为46,该物质的分子式是C2H6O.
(3)根据价键理论,预测A的可能结构并写出结构简式CH3CH2OH、CH3OCH3.
(二)结构式的确定:
(4)核磁共振氢谱能对有机物分子3种不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目.例如:甲基氯甲基醚(Cl-CH2-O-CH3)有两种氢原子如图②.经测定,有机物A的核磁共振氢谱示意图如图③,则A的结构简式为CH3CH2OH.
分析 (一)(1)根据n=$\frac{m}{M}$计算水、二氧化碳物质的量,进而确定n(C)、n(H),根据n=$\frac{V}{{V}_{m}}$计算氧气物质的量,根据O原子守恒计算有机物中含有O原子物质的量,据此解答;
(2)根据质荷比可以确定相对分子质量,结合有机物分子中C、H、O原子数目之比确定分子式;
(3)结合A的分子式书写可能的结构简式;
(二)(4)有机物A的核磁共振氢谱中有3个吸收峰,说明有3种性质不同的H原子.
解答 解:(一)(1)5.4gH2O的物质的量=$\frac{5.4g}{18g/mol}$=0.3mol,则n(H)=0.6mol,8.8gCO2的物质的量=$\frac{8.8g}{44g/mol}$=0.2mol,则n(C)=0.2mol,
6.72LO2的物质的量$\frac{6.72L}{22.4L/mol}$=0.3mol,
由O元素守恒可知有机物中含有n(O)=0.3mol+0.2mol×2-0.3mol×2=0.1mol,
则n(C):n(H):n(O)=2:6:1,
所以有机化合物的实验式为C2H6O;
故答案为:C2H6O;
(2)有机化合物的实验式为C2H6O,由质荷比可知相对分子质量为46,则分子式为C2H6O,
故答案为:46;C2H6O;
(3)有机物A的可能结构简式有:CH3CH2OH、CH3OCH3,
故答案为:CH3CH2OH、CH3OCH3;
(二)(4)有机物A的核磁共振氢谱中有3个吸收峰,说明有3种性质不同的H原子,故A的结构为:CH3CH2OH,故答案为:3;CH3CH2OH.
点评 本题考查有机物结构确定,题目难度中等,从守恒角度判断有机物最简式为解答该题的关键,注意理解质谱图、核磁共振氢谱、红外光谱在有机物结构确定中的作用.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| A. | 2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO | B. | Zn+2HCl═ZnCl2+H2↑ | ||
| C. | 2O3$\frac{\underline{\;催化剂\;}}{\;}$3 O2 | D. | CuO+H2$\frac{\underline{\;高温\;}}{\;}$Cu+H2O |
| A. | Ba2+、Ca2+、OH-、HCO3- | B. | H+、K+、NH4+、SO42- | ||
| C. | NO3-、SO42-、K+、Mg2+ | D. | H+、Na+、NO3-、Cu2+ |
| A. | O2、O3 | B. | H2O、D2O | C. | H、D | D. | 1944K、2040Ca |
| A. | 铝在空气中耐腐蚀,所以铝是不活泼金属 | |
| B. | 点燃的镁条插入盛有二氧化碳的集气瓶里,则迅速熄灭 | |
| C. | 铝在高温下能还原锰、铁、铬等金属的氧化物 | |
| D. | 因为镁和铝在空气中都能形成氧化膜,所以镁和铝都不溶于浓硝酸 |
| A. | AB | B. | BA2 | C. | AB4 | D. | B3A2 |
| A. | 35Cl原子所含质子数为18 | |
| B. | $\frac{1}{18}$mol的1H35Cl分子所含中子数约为6.02×1023 | |
| C. | 气体35Cl2的摩尔质量为70 | |
| D. | 3.5g的气体35Cl2的体积为2.24L |

 、
、 .
.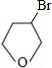 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$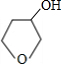 +NaBr.
+NaBr.