题目内容
工业上用粉碎的煤矸石(主要含Al203、Si02及铁的氧化物)制备净水剂 BAC〔Al2(OH)nCl6-n〕的流程如下:

(1)粉碎煤矸石的目的是 ;滤渣I的主要成分是 (填化学式).
(2)步骤①在煮沸的过程中,溶液逐渐由无色变为绿色,此时溶液中有色离子为 (填化学式);随后溶液又变为棕黄色,相关离子反应方程式为 ;
步骤①的煮沸装置上方需安装一长导管,长导管的作用是 .
(3)步骤②中加入适量的Ca(OH)2并控制pH,其目的:一是生成BAC;二是;已知BAC的分散质粒子大小在1nm?100nm之间,由此区别滤液I与BAC两种液体的物理方法是 ;若Ca(OH)2溶液过量,则步骤③得到的BAC产率偏低,写出该反应的离子方程式 .
(4)若0.1mol AlCl3在某温度下溶于蒸馏水,当有5%水解生成Al(OH)3溶液时,吸 收热量a kJ.写出该过程的热化学方程式 .

(1)粉碎煤矸石的目的是
(2)步骤①在煮沸的过程中,溶液逐渐由无色变为绿色,此时溶液中有色离子为
步骤①的煮沸装置上方需安装一长导管,长导管的作用是
(3)步骤②中加入适量的Ca(OH)2并控制pH,其目的:一是生成BAC;二是;已知BAC的分散质粒子大小在1nm?100nm之间,由此区别滤液I与BAC两种液体的物理方法是
(4)若0.1mol AlCl3在某温度下溶于蒸馏水,当有5%水解生成Al(OH)3溶液时,吸 收热量a kJ.写出该过程的热化学方程式
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:煤矸石(主要含Al203、Si02及铁的氧化物)加入硫酸和盐酸,Si02不溶,Al203及铁的氧化物溶解为离子,滤渣I为Si02,滤液调节PH,三价铁离子会转化为沉淀,则滤渣II为氢氧化铁,滤液II再经过蒸发浓缩,过滤得到硫酸钙和BAC溶液;
(1)根据固体的表面积对反应速率的影响分析;二氧化硅不溶于酸;
(2)Fe2+在溶液中为绿色;Fe2+易被空气中的氧气氧化为Fe3+;根据盐酸具有挥发性分析;
(3)根据胶体的性质及鉴别方法分析;Al3+与过量的强碱反应生成偏铝酸盐;
(4)根据水解 AlCl3的量,求出1mol完全反应吸收的热量,再写出热化学方程式.
(1)根据固体的表面积对反应速率的影响分析;二氧化硅不溶于酸;
(2)Fe2+在溶液中为绿色;Fe2+易被空气中的氧气氧化为Fe3+;根据盐酸具有挥发性分析;
(3)根据胶体的性质及鉴别方法分析;Al3+与过量的强碱反应生成偏铝酸盐;
(4)根据水解 AlCl3的量,求出1mol完全反应吸收的热量,再写出热化学方程式.
解答:
解:煤矸石(主要含Al203、Si02及铁的氧化物)加入硫酸和盐酸,Si02不溶,Al203及铁的氧化物溶解为离子,滤渣I为Si02,滤液调节PH,三价铁离子会转化为沉淀,则滤渣II为氢氧化铁,滤液II再经过蒸发浓缩,过滤得到硫酸钙和BAC溶液;
(1)有固体参加的反应,固体的表面积越大,反应速率越快,所以粉碎煤矸石能增大接触面积,加快溶解速率;二氧化硅不溶于酸,所以滤渣I为Si02;
故答案为:增大接触面积,加快溶解速率;Si02;
(2)Fe2+在溶液中为绿色;Fe2+易被空气中的氧气氧化为Fe3+,随后溶液又变为棕黄色,是因为Fe2+被空气中的氧气氧化为Fe3+,其反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,盐酸具有挥发性,在加热煮沸时易挥发,所以用长玻璃导管来冷凝、回流;
故答案为:Fe2+;4Fe2++O2+4H+=4Fe3++2H2O;冷凝、回流;
(3)已知BAC的分散质粒子大小在1nm?100nm之间,则BAC为胶体,滤液I为溶液,用一束光照射液体,观察是否有丁达尔效应,有丁达尔效应的是BAC;Al3+与过量的强碱反应生成偏铝酸盐,所以若Ca(OH)2溶液过量,则步骤③得到的BAC产率偏低,该反应的离子方程式为Al3++4OH-=AlO2-+2H2O;
故答案为:用一束光照射液体,观察是否有丁达尔效应;Al3++4OH-=AlO2-+2H2O;
(4)若0.1mol AlCl3在某温度下溶于蒸馏水,当有5%水解生成Al(OH)3溶液时,吸 收热量a kJ,则1mol完全反应水解吸收的热量为200aKJ,则其热化学方程式为:ACl3(aq)+3H2O(l)
Al(OH)3(aq)+3HCl(aq)△H=+200aKJ/mol;
故答案为:AlCl3(aq)+3H2O(l)
Al(OH)3(aq)+3HCl(aq)△H=+200aKJ/mol.
(1)有固体参加的反应,固体的表面积越大,反应速率越快,所以粉碎煤矸石能增大接触面积,加快溶解速率;二氧化硅不溶于酸,所以滤渣I为Si02;
故答案为:增大接触面积,加快溶解速率;Si02;
(2)Fe2+在溶液中为绿色;Fe2+易被空气中的氧气氧化为Fe3+,随后溶液又变为棕黄色,是因为Fe2+被空气中的氧气氧化为Fe3+,其反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,盐酸具有挥发性,在加热煮沸时易挥发,所以用长玻璃导管来冷凝、回流;
故答案为:Fe2+;4Fe2++O2+4H+=4Fe3++2H2O;冷凝、回流;
(3)已知BAC的分散质粒子大小在1nm?100nm之间,则BAC为胶体,滤液I为溶液,用一束光照射液体,观察是否有丁达尔效应,有丁达尔效应的是BAC;Al3+与过量的强碱反应生成偏铝酸盐,所以若Ca(OH)2溶液过量,则步骤③得到的BAC产率偏低,该反应的离子方程式为Al3++4OH-=AlO2-+2H2O;
故答案为:用一束光照射液体,观察是否有丁达尔效应;Al3++4OH-=AlO2-+2H2O;
(4)若0.1mol AlCl3在某温度下溶于蒸馏水,当有5%水解生成Al(OH)3溶液时,吸 收热量a kJ,则1mol完全反应水解吸收的热量为200aKJ,则其热化学方程式为:ACl3(aq)+3H2O(l)
| 某温度 |
故答案为:AlCl3(aq)+3H2O(l)
| 某温度 |
点评:本题考查了工艺流程图,主要涉及Al203、Si02及铁的氧化物的分离和提纯、胶体的性质和鉴别、热化学方程式等,题目考查的内容较多,侧重于考查学生对所学知识的综合应用能力.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
 炭雕(如图所示)是一种集观赏与空气净化为一体的产品,这种产品可对车内及室内空气中的一氧化碳、苯、甲醛、烟雾等有害气体进行有效吸附.取一块制作炭雕的下脚料,进行下面的实验.下列有关叙述不正确的是( )
炭雕(如图所示)是一种集观赏与空气净化为一体的产品,这种产品可对车内及室内空气中的一氧化碳、苯、甲醛、烟雾等有害气体进行有效吸附.取一块制作炭雕的下脚料,进行下面的实验.下列有关叙述不正确的是( )| A、将炭雕下脚料在空气中点燃,可以得到使澄清石灰水变浑浊的气体 |
| B、将炭雕下脚料研成粉末,加入到稀的红墨水中,红墨水褪色 |
| C、将炭雕下脚料研成粉末,与氧化铜粉末混合加热,可以得到红色固体 |
| D、将炭雕下脚料加入到盛有氯气的集气瓶中,静置一段时间,黄绿色变浅,其原因是炭雕下脚料中的物质与氯气发生氧化还原反应 |
下列关于范德华力的叙述中,正确的是( )
| A、范德华力的实质也是一种电性作用,所以范德华力是一种特殊化学键 |
| B、任何分子间在任意情况下都会产生范德华力 |
| C、范德华力与化学键的区别是作用力的强弱问题 |
| D、范德华力非常微弱,故破坏范德华力不需要消耗能量 |
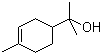 )的分子式为
)的分子式为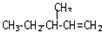 一定条件发生加聚反应时的化学方程式
一定条件发生加聚反应时的化学方程式 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下: A、B、C、D、E为短周期元素且原子序数依次增大,其中A含有3个能级且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物的水化物酸性最强.
A、B、C、D、E为短周期元素且原子序数依次增大,其中A含有3个能级且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物的水化物酸性最强.