题目内容
下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)写由上述元素组成的分子中电子总数为10的分子(至少两种): .
(2)比较:②、③、④、⑤的第一电离能: > > > (写元素符号).
(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 ;碱性最强的化合物的电子式是:
(4)具有两性的最高价氧化物是 (填化学式);写出其与氢氧化钠溶液反应的离子方程式: .
(5)下表为原子序数依次增大的短周期元素A~E的第一到第五电离能数据.
试回答:表中可能为非金属元素的是 (填字母);若D、E为同周期相邻元素,表中D比E的第一电离能略大,其原因是 .
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ | |||||||
(2)比较:②、③、④、⑤的第一电离能:
(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是
(4)具有两性的最高价氧化物是
(5)下表为原子序数依次增大的短周期元素A~E的第一到第五电离能数据.
| 电离能I(eV) | A | B | C | D | E |
| I1 | 11.3 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 113.9 | 138.3 | 141.3 | 153.7 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中的位置可知,①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为P、⑧为Cl、⑨为Ar、⑩为K.
(1)由上述元素组成电子总数为10的分子有甲烷、氨气、水;
(2)同周期自左而右元素第一电离能呈增大趋势,但N元素2p轨道容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素;
(3)最高价氧化物的水化物中,酸性最强是高氯酸;上述元素中K的金属性最强,故KOH碱性最强,KOH由钾离子与氢氧根离子构成;
(4)氧化铝能与酸、碱反应得到盐与水,是两性氧化物,氧化铝与氢氧化钠反应生成偏铝酸钠与水;
(5)非金属元素第一个电子不易失去,非金属元素的第一电离能比较大,通过表格可以看出AB的第一电离能比较大,为非金属元素;
D的第三电离能剧增,最外层电子数为2,可知D处于ⅡA族,E的第三电离能剧增,最外层电子数为3,则E处于ⅢA族,D的s轨道上的电子全充满,能量低,自身更稳定.
(1)由上述元素组成电子总数为10的分子有甲烷、氨气、水;
(2)同周期自左而右元素第一电离能呈增大趋势,但N元素2p轨道容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素;
(3)最高价氧化物的水化物中,酸性最强是高氯酸;上述元素中K的金属性最强,故KOH碱性最强,KOH由钾离子与氢氧根离子构成;
(4)氧化铝能与酸、碱反应得到盐与水,是两性氧化物,氧化铝与氢氧化钠反应生成偏铝酸钠与水;
(5)非金属元素第一个电子不易失去,非金属元素的第一电离能比较大,通过表格可以看出AB的第一电离能比较大,为非金属元素;
D的第三电离能剧增,最外层电子数为2,可知D处于ⅡA族,E的第三电离能剧增,最外层电子数为3,则E处于ⅢA族,D的s轨道上的电子全充满,能量低,自身更稳定.
解答:
解:由元素在周期表中的位置可知,①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为P、⑧为Cl、⑨为Ar、⑩为K.
(1)由上述元素组成电子总数为10的分子有CH4、NH3、H2O,故答案为:CH4、NH3、H2O(任意2种);
(2)Na为金属元素,其它为非金属元素,故Na的第一电离能最小,同周期自左而右元素第一电离能呈增大趋势,但N元素2p轨道容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:N>O>C>Na,故答案为:N>O>C>Na;
(3)最高价氧化物的水化物中,酸性最强是高氯酸,化学式为HClO4;上述元素中K的金属性最强,故KOH碱性最强,KOH由钾离子与氢氧根离子构成,电子式为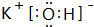 ,
,
故答案为:HClO4;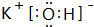 ;
;
(4)氧化铝能与酸、碱反应得到盐与水,是两性氧化物,化学式为Al2O3,氧化铝与氢氧化钠反应生成偏铝酸钠与水,离子方程式为:Al2O3+2OH-=2 Al O2-+H2O,故答案为:Al2O3;Al2O3+2OH-=2AlO2-+H2O;
(5)非金属元素第一个电子不易失去,非金属元素的第一电离能比较大,通过表格可以看出AB的第一电离能比较大,为非金属元素;
D的第三电离能剧增,最外层电子数为2,可知D处于ⅡA族,E的第三电离能剧增,最外层电子数为3,则E处于ⅢA族,D的s轨道上的电子全充满,能量低,自身更稳定.
故答案为:AB;D的s轨道上的电子全充满,能量低,自身更稳定.
(1)由上述元素组成电子总数为10的分子有CH4、NH3、H2O,故答案为:CH4、NH3、H2O(任意2种);
(2)Na为金属元素,其它为非金属元素,故Na的第一电离能最小,同周期自左而右元素第一电离能呈增大趋势,但N元素2p轨道容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:N>O>C>Na,故答案为:N>O>C>Na;
(3)最高价氧化物的水化物中,酸性最强是高氯酸,化学式为HClO4;上述元素中K的金属性最强,故KOH碱性最强,KOH由钾离子与氢氧根离子构成,电子式为
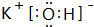 ,
,故答案为:HClO4;
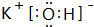 ;
;(4)氧化铝能与酸、碱反应得到盐与水,是两性氧化物,化学式为Al2O3,氧化铝与氢氧化钠反应生成偏铝酸钠与水,离子方程式为:Al2O3+2OH-=2 Al O2-+H2O,故答案为:Al2O3;Al2O3+2OH-=2AlO2-+H2O;
(5)非金属元素第一个电子不易失去,非金属元素的第一电离能比较大,通过表格可以看出AB的第一电离能比较大,为非金属元素;
D的第三电离能剧增,最外层电子数为2,可知D处于ⅡA族,E的第三电离能剧增,最外层电子数为3,则E处于ⅢA族,D的s轨道上的电子全充满,能量低,自身更稳定.
故答案为:AB;D的s轨道上的电子全充满,能量低,自身更稳定.
点评:本题考查了元素周期表、元素周期律的综合运用,难度中等,注意电离能与化合价关系、同一周期元素第一电离能的规律及异常现象.

练习册系列答案
相关题目
一定温度下,将少量生石灰放入一定量的饱和石灰水中,搅拌并冷却到原温度,下列说法正确的是( )
| A、溶质的质量增大 |
| B、溶质的物质的量浓度增大 |
| C、Ca(OH)2浓度不变 |
| D、溶质的质量分数增大 |
化学与工农业生产、环境保护、日常生活等方面有广泛联系,下列叙述正确的是( )
| A、塑料袋在全球“失宠”,是因为塑料袋填埋占用土地,且难以降解 |
| B、举行“地球一小时”熄灯活动,会影响经济发展及社会生活,所以不宜推广 |
| C、有色玻璃是某些胶态金属分散于玻璃中制成的胶体 |
| D、太阳能是目前人类生产生活直接利用的、转化效率最高的能源 |
有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质不同.下列各项事实不能说明上述观点的是( )
| A、甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色 |
| B、乙烯能发生加成反应,而乙烷不能发生加成反应 |
| C、苯与硝酸在加热的条件下发生取代反应,而甲苯在常温下就能与硝酸发生反应 |
| D、2-甲基-1-丙烯与溴的CCl4溶液加成速率比乙烯与溴的CCl4溶液加成速率快 |

 二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:

