题目内容
 已知金属活动相差越大,形成原电池时越容易放电.请根据如图装置,回答下列问题:
已知金属活动相差越大,形成原电池时越容易放电.请根据如图装置,回答下列问题:(1)各装置名称是:A池
(2)写出电极上发生的反应:①
(3)当电路上有2mol电子流过时,①极上质量变化
(4)反应进行一段时间后,A、B、C三池中电解质溶液浓度不变的是
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)A是能自发进行的氧化还原反应,且符合原电池的构成条件,所以属于原电池,B、C有外接电源,属于电解池;
(2)A原电池中,锌作负极,负极上锌失电子发生氧化反应,B是电解池,③作阳极,阳极上氯离子放电,⑤为阳极,发生氧化反应;
(3)①锌被氧化,⑥中铜电极上银离子得电子析出,根据锌、银和电子之间的关系式解答;
(4)电镀池的电解质溶液浓度不变.
(2)A原电池中,锌作负极,负极上锌失电子发生氧化反应,B是电解池,③作阳极,阳极上氯离子放电,⑤为阳极,发生氧化反应;
(3)①锌被氧化,⑥中铜电极上银离子得电子析出,根据锌、银和电子之间的关系式解答;
(4)电镀池的电解质溶液浓度不变.
解答:
解:(1)A是能自发进行的氧化还原反应,且符合原电池的构成条件,所以属于原电池,B有外接电源,属于电解池,C为电解池或电镀池,
故答案为:原电池;电解池;电镀池(电解池);
(2)A原电池中,锌作负极,负极上锌失电子发生氧化反应,电极反应式为:Zn-2e-=Zn2+,
B是电解池,③作阳极,阳极上氯离子放电生成氯气,电极反应式为:2Cl--2e-=Cl2↑,
C是电镀池,⑤为阳极,发生氧化反应,电极方程式为2Ag-2e-═2Ag+,
故答案为:Zn-2e-═Zn2+;2Cl--2e-═Cl2↑;2Ag-2e-═2Ag+;
(3)当电路上有2mol电子流过时,
①锌被氧化,电极反应式为:Zn-2e-=Zn2+,当电路上有2mol电子流过时,氧化锌的质量为1mol×65g/mol=65g,
⑥中铜电极上银离子得电子析出,电极反应式为:Ag++e-=Ag,当电路上有2mol电子流过时析出银的质量=2mol×108g/mol=216g,
故答案为:65;216;
(4)C为电镀池,溶液浓度不变,故答案为:C池.
故答案为:原电池;电解池;电镀池(电解池);
(2)A原电池中,锌作负极,负极上锌失电子发生氧化反应,电极反应式为:Zn-2e-=Zn2+,
B是电解池,③作阳极,阳极上氯离子放电生成氯气,电极反应式为:2Cl--2e-=Cl2↑,
C是电镀池,⑤为阳极,发生氧化反应,电极方程式为2Ag-2e-═2Ag+,
故答案为:Zn-2e-═Zn2+;2Cl--2e-═Cl2↑;2Ag-2e-═2Ag+;
(3)当电路上有2mol电子流过时,
①锌被氧化,电极反应式为:Zn-2e-=Zn2+,当电路上有2mol电子流过时,氧化锌的质量为1mol×65g/mol=65g,
⑥中铜电极上银离子得电子析出,电极反应式为:Ag++e-=Ag,当电路上有2mol电子流过时析出银的质量=2mol×108g/mol=216g,
故答案为:65;216;
(4)C为电镀池,溶液浓度不变,故答案为:C池.
点评:本题考查了原电池和电解池原理,难度不大,正确判断原电池和电解池是解本题关键,电极反应式的书写是学习难点.

练习册系列答案
相关题目
 一种新型酸性乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍,电池反应式为C2H5OH+3O2=2CO2+3H2O,电池构造如图.下列关于该电池的说法不正确的是
一种新型酸性乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍,电池反应式为C2H5OH+3O2=2CO2+3H2O,电池构造如图.下列关于该电池的说法不正确的是( )
| A、放电过程中,电源内部的H+从正极区向负极区迁移 |
| B、通入乙醇的电极是负极 |
| C、该电池的正极反应为:4H++O2+4e-=2H2O |
| D、用该电池做为电源,用惰性电极电解饱和NaCl的水溶液时,每消耗0.2 mol C2H5OH,阳极产生标准状况下气体的体积为26.88 L |
下表是在相同温度下三种酸的一些数据,下列判断正确的是( )
| 酸 | HX | HY | HZ | ||
| 浓度(mol/L) | 0.12 | 0.2 | 0.9 | 1 | 1 |
| 电离度 | 0.25 | 0.2 | 0.1 | 0.3 | 0.5 |
| 电离常数 | K1 | K2 | K3 | K4 | K5 |
| A、在相同温度,从HX的数据可以说明:弱电解质溶液,浓度越低,电离度越大,且K1>K2>K3 | ||
B、室温时,若在NaZ溶液中加水,则
| ||
| C、等物质的量的NaX、NaY和NaZ的混合,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-) | ||
| D、在相同温度下,K5>K4>K3 |
用下列实验装置完成对应的实验?部分仪器已省略,能达到实验目的是?( )
A、 干燥Cl2 |
B、 吸收HCl |
C、 石油的蒸馏 |
D、 吸收NH3 |
下列离子方程式正确的是( )
| A、硫酸与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | ||||
| B、铝和氢氧化钠溶液反应:Al+OH-+3H2O═Al(OH)4-+H2↑ | ||||
| C、向次氯酸钠溶液中通入足量SO2 气体:ClO-+SO2+H2O═HClO+HSO3- | ||||
D、向沸水中逐滴加入FeCl3饱和溶液:Fe3++3H2O
|

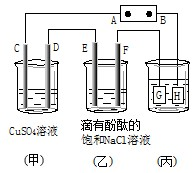 如图装置所示,C、D、E、F都是惰性电极,
如图装置所示,C、D、E、F都是惰性电极,