题目内容
5.NaHSO4在水中的电离方程式:NaHSO4=Na++H++SO42-;若将NaHSO4与Ba(OH)2在溶液中按物质的量2:1混合,反应的离子方程式是Ba2++2OH-+2H++SO42-=2H2O+BaSO4↓.分析 硫酸氢钠为强电解质,水中完全电离;NaHSO4与Ba(OH)2在溶液中按物质的量2:1混合,反应生成硫酸钡、硫酸钠和水.
解答 解:硫酸氢钠为强电解质,水中完全电离,电离方程式:NaHSO4=Na++H++SO42-;
NaHSO4与Ba(OH)2在溶液中按物质的量2:1混合,反应生成硫酸钡、硫酸钠和水,离子方程式:Ba2++2OH-+2H++SO42-=2H2O+BaSO4↓;
故答案为:NaHSO4=Na++H++SO42-;Ba2++2OH-+2H++SO42-=2H2O+BaSO4↓.
点评 本题考查了电解质电离方程式的书写、离子方程式的书写,明确电解质强弱是解题关键,注意反应物用量对离子反应的影响,题目难度不大.

练习册系列答案
相关题目
1.用NA表示阿伏加德罗常数的数值.下列叙述正确的是( )
| A. | 100mL0.1mol•L-1FeCl3溶液中含有Fe3+的数目为0.01NA | |
| B. | 在铜与单质硫的反应中,1mol铜失去的电子数为2NA | |
| C. | 15.6g由Na2S和Na2O2组成的固体混合物中,含有的阴离子数为0.2NA | |
| D. | 104g苯乙烯(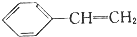 )中含有碳氢键的数目和碳碳双键的数目分别为8NA和4NA )中含有碳氢键的数目和碳碳双键的数目分别为8NA和4NA |
20.2.8g Fe全部溶于一定浓度、200mL的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液的pH为1.若反应前后溶液体积变化忽略不计,则下列有关判断正确的是( )
| A. | 反应后溶液中铁元素可能以Fe2+形式存在 | |
| B. | 反应后溶液中c(N03-)=0.85 mol/L | |
| C. | 反应后的溶液最多还能溶解1.4 g Fe | |
| D. | 1.12 L气体可能是NO、NO2的混合气体 |
10.下表是验证饱和氯水中所含主要粒子的实验操作和实验现象,请根据实验要求将相应的操作和现象的标号填在答案栏内.
①将氯水滴入有机色素品红溶液中
②在氯水中滴加紫色石蕊试液
③在氯水中滴加AgNO3溶液
④将湿润的淀粉碘化钾试纸置于氯水试剂瓶上方
A.有白色沉淀生成
B.试纸有白色变成蓝色
C.品红由红色变成无色
D.滴入瞬间溶液显红色随即又褪去.
| 粒子 | 操作 | 现象 | 现象 | |
| a | H+ | |||
| b | Cl- | |||
| c | Cl2 | |||
| d | HClO |
②在氯水中滴加紫色石蕊试液
③在氯水中滴加AgNO3溶液
④将湿润的淀粉碘化钾试纸置于氯水试剂瓶上方
A.有白色沉淀生成
B.试纸有白色变成蓝色
C.品红由红色变成无色
D.滴入瞬间溶液显红色随即又褪去.
17.相同物质的量浓度的下列物质的稀溶液,PH最小的是( )
| A. | 乙醇溶液 | B. | CH3COONa溶液 | C. | CH3COOH溶液 | D. | 碳酸 |
14.陶瓷是传统硅酸盐产品,根据陶瓷的生产原理,可以得出硅酸盐工业的一般特点是( )
①以含硅物质作为原料 ②主要产物是硅酸盐 ③反应条件是高温 ④反应原理是复杂的物理变化和化学变化.
①以含硅物质作为原料 ②主要产物是硅酸盐 ③反应条件是高温 ④反应原理是复杂的物理变化和化学变化.
| A. | 只有①③ | B. | 只有②③ | C. | ①②③④ | D. | 只有③④ |
15.将标准状况下2.24L H2S缓缓通入到100mL l mol/L NaOH溶液中充分反应后,溶液中c(H2S)>c(S2-).下列叙述正确的是( )
| A. | 整个过程中,H20的电离度逐渐增大 | B. | c(Na+)>c(HS-)>c(H+)>c(S2-)>c(0H-) | ||
| C. | c(Na+)+c(H+)═c(0H-)+c(HS-)+2c(S2-) | D. | c(Na+)═c(HS-)+c(H2S) |