题目内容
下列说法正确的是( )
| A、碳酸氢钠的热稳定性小于碳酸钠的 |
| B、Fe在足量Cl2中燃烧生成FeCl2和FeCl3 |
| C、可用石灰水区分Na2CO3与NaHCO3溶液 |
| D、滴加石蕊试液显红色的溶液:Fe3+、NH4+、I-可能大量共存 |
考点:钠的重要化合物,离子共存问题,铁的化学性质
专题:元素及其化合物
分析:A、碳酸氢钠加热分解生成碳酸钠、二氧化碳与水;
B、因为氯气具有强氧化性,所以Fe在足量Cl2中燃烧只能生成FeCl3;
C、石灰水与Na2CO3与NaHCO3溶液都发生反应生成碳酸钙沉淀;
D、滴加石蕊试液显红色的溶液,显酸性.
B、因为氯气具有强氧化性,所以Fe在足量Cl2中燃烧只能生成FeCl3;
C、石灰水与Na2CO3与NaHCO3溶液都发生反应生成碳酸钙沉淀;
D、滴加石蕊试液显红色的溶液,显酸性.
解答:
解:A、碳酸氢钠加热发生分解反应2NaHCO3
Na2CO3+CO2↑+H2O,而碳酸钠加热不分解,故A正确;
B、因为氯气具有强氧化性,所以Fe在足量Cl2中燃烧只能生成FeCl3,故B错误;
C、石灰水与Na2CO3与NaHCO3溶液都发生反应生成碳酸钙沉淀,所以不能用石灰水区分,故C错误;
D、滴加石蕊试液显红色的溶液,显酸性,因为三价铁具有氧化性,碘离子具有强还原性,所以两者要发生氧化还原反应,则不能共存,故D错误.
故选:A.
| ||
B、因为氯气具有强氧化性,所以Fe在足量Cl2中燃烧只能生成FeCl3,故B错误;
C、石灰水与Na2CO3与NaHCO3溶液都发生反应生成碳酸钙沉淀,所以不能用石灰水区分,故C错误;
D、滴加石蕊试液显红色的溶液,显酸性,因为三价铁具有氧化性,碘离子具有强还原性,所以两者要发生氧化还原反应,则不能共存,故D错误.
故选:A.
点评:本题考查Na2CO3和NaHCO3性质的异同,氯气、三价铁离子的强氧化性、题目难度不大,注意把握Na2CO3和NaHCO3性质,注重基础知识的积累.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
铝用作焊接钢轨是利用( )
| A、铝同氧气反应生成稳定的保护层 |
| B、铝是热的良导体 |
| C、铝合金强度大 |
| D、铝是强还原剂,铝热反应放热 |
标准状况下,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,充入时体积如图所示,若将装置右边H2、O2的混合气体点燃引爆,活塞先左弹,恢复至原温度后,活塞右滑最终停在容器的正中央,则原来H2、O2的体积比最接近于( )
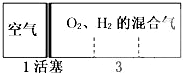
①2:7 ②5:4 ③4:5 ④7:2.
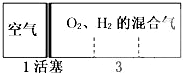
①2:7 ②5:4 ③4:5 ④7:2.
| A、①② | B、②④ | C、③④ | D、①③ |
下列各组物质中一定互为同系物的是( )
| A、C2H2,苯 |
| B、C2H4,C8H8 |
| C、CH4,C4H10 |
| D、C2H6,C2H6O |
下列有关钠、铁、铝性质的说法中不正确的是( )
| A、钠、铝均能从FeCl3溶液中置换出铁单质 |
| B、均能与盐酸反应,但金属钠与盐酸的反应最剧烈 |
| C、在地壳中的含量:Al>Fe>Na |
| D、钠、铝均能与NaOH溶液反应,但参加反应的物质种类前者少于后者 |
对可逆反应4A(g)+5B(g)?4C(g)+6D(g)△H>0,下列叙述中,正确的是( )
| A、化学反应速率关系是:2v正(A)=3v正(D) |
| B、若单位时间内生成x mol C的同时,消耗x mol A,则反应一定处于平衡状态 |
| C、达到化学平衡后,增大容器的容积,则正反应速率减小,逆反应速率增大 |
| D、达到化学平衡后,升高温度,则C的质量分数增大 |
下列表示正确的是( )
| A、HClO的结构式:H-O-Cl |
B、H2O2的电子式: |
C、CO2的比例模型: |
D、14C的原子结构示意图: |
 请回答下列问题:
请回答下列问题: