题目内容
4.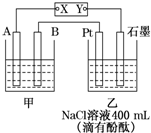 如图为相互串联的甲乙两个电解池,X、Y为直流电源的两个电极.电解过程中,发现石墨电极附近先变红.请回答:
如图为相互串联的甲乙两个电解池,X、Y为直流电源的两个电极.电解过程中,发现石墨电极附近先变红.请回答:(1)电源X极为正极(填“正”或“负”),乙池中Pt电极上的电极反应式为2Cl--2e-═Cl2↑.
(2)甲池若为电解精炼铜的装置,其阴极增重12.8g,则乙池中阴极上放出的气体在标准状况下的体积为4.48 L,电路中通过的电子为0.4 mol.
(3)在(2)的情况下,若乙池剩余溶液的体积仍为400mL,则电解后所得溶液c(OH-)=1 mol•L-1.
分析 (1)石墨电极附近先变红,说明石墨附近氢离子浓度减小,氢氧根浓度增大,即石墨为阴极,则Y为负极,X为正极,Pt电极为阳极,阳极上氯离子失电子生成氯气;
(2)甲池若为电解精炼铜的装置,阴极铜离子得电子生成Cu,根据转移电子守恒计算;
(3)根据电解方程式计算生成的氢氧根离子的物质的量浓度.
解答 解:(1)石墨电极附近先变红,说明石墨附近氢离子浓度减小,氢氧根浓度增大,即石墨为阴极,则Y为负极,X为正极,Pt电极为阳极,阳极上氯离子失电子生成氯气,则乙池中Pt电极上的电极反应式为2Cl--2e-═Cl2↑;
故答案为:正;2Cl--2e-═Cl2↑;
(2)甲池若为电解精炼铜的装置,阴极铜离子得电子生成Cu,则Cu的物质的量为$\frac{12.8g}{64g/mol}$=0.2mol,由电极反应:Cu2++2e-=Cu可知,电解过程中共有0.4mol电子转移,乙池中阴极上电极反应为2H++2e-=H2↑,由电子守恒可知,生成的氢气为0.2mol,其体积为4.48L;
故答案为:4.48 L;0.4;
(3)电解氯化钠溶液的离子方程式为2H2O+2Cl-$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-,反应中转移0.4mol电子,则生成氢氧根离子为0.4mol,所以c(OH-)=$\frac{0.4mol}{0.4L}$=1mol•L-1;
故答案为:1mol•L-1.
点评 本题考查了电解池的工作原理的应用、电极判断方法、电极反应的书写、电子守恒的计算应用等,注意把握串联电解池转移电子守恒是解题关键,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.模拟推理是化学学习中的一种重要方法.下列类推结论中正确的是( )
| 模拟对象 | 类推结论 | |
| A | 2HCl+Mg═MgCl2+H2↑ | H2SO4+2Na═Na2SO4+H2↑ |
| B | Cl2+2Fe2+═2 Fe3++2Cl- | I2+2Fe2+═2Fe3++2I- |
| C | Mg在O2中燃烧生成MgO | Na在O2中燃烧生成Na2O |
| D | Al在NaOH溶液中反应可产生H2 | Mg与NaOH溶液反应也可以产生H2 |
| A. | A | B. | B | C. | C | D. | D |
11.某无色气体,可以使湿润的蓝色石蕊试纸变红,通入澄清石灰水中,石灰水变浑浊,接着又变澄清,将燃着的蜡烛放入盛有该气体的集气瓶中蜡烛熄灭,则该气体( )
| A. | 一定是CO2 | B. | 一定是SO2 | ||
| C. | 可能是CO2或SO2 | D. | 一定是CO2和SO2混合气体 |
18.常温下,下列各组离子在指定环境中能大量共存的是( )
| A. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1013的溶液中:NH4+、Ca2+、Cl-、K+ | |
| B. | Kw/c(OH-)=1.0mol•L-1的溶液中:Mg2+、NO3、NH4+、I- | |
| C. | 中性溶液中:K+、Cl-、Na+、CO32- | |
| D. | 无色溶液中:Fe3+、Cl-、Na+、SCN- |
9.海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法不正确的是( )
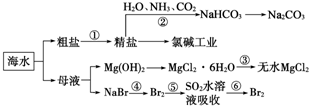

| A. | 过程①中除去粗盐中的SO${\;}_{4}^{2-}$、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 过程②中应先通入NH3再通入CO2气体 | |
| C. | 过程③中结晶出的MgCl2•6H2O要在HCl氛围中加热脱水制得无水MgCl2 | |
| D. | 从第⑤~⑥步的目的是浓缩、富集溴单质 |
16.X、Y、Z、W为四种常见的短周期元素.其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示:
请回答下列问题:
(1)W位于周期表中第三周期,第VIIA族.
(2)X和氢可以构成+1价阳离子,其电子式是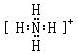 ,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).
,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,该反应的化学方程式为2S2Cl2+2H2O═3S↓+SO2↑+4HCl.
(4)①Y和Z可组成一种气态化合物Q,Q能与W的单质在潮湿环境中反应,反应的化学方程式是SO2+Cl2+2H2O=2HCl+H2SO4.
②在一定条件下,化合物Q与Y的单质反应达平衡时有三种气态物质,反应时,每转移4mol电子放热190.0kJ,该反应的热化学方程式是2SO2 (g)+O2(g)?2SO3(g)△H=-190.0 kJ•mol-1.
| X | Y | |
| Z | W |
(1)W位于周期表中第三周期,第VIIA族.
(2)X和氢可以构成+1价阳离子,其电子式是
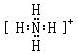 ,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).
,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,该反应的化学方程式为2S2Cl2+2H2O═3S↓+SO2↑+4HCl.
(4)①Y和Z可组成一种气态化合物Q,Q能与W的单质在潮湿环境中反应,反应的化学方程式是SO2+Cl2+2H2O=2HCl+H2SO4.
②在一定条件下,化合物Q与Y的单质反应达平衡时有三种气态物质,反应时,每转移4mol电子放热190.0kJ,该反应的热化学方程式是2SO2 (g)+O2(g)?2SO3(g)△H=-190.0 kJ•mol-1.
13. 用如图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是( )
用如图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是( )
 用如图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是( )
用如图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是( )| ①中实验 | ②中现象 | |
| A | 铁粉与水蒸气加热 | 肥皂水冒泡 |
| B | 加热NH4Cl和Ca(OH)2混合物 | 酚酞溶液变红 |
| C | NaHC03固体受热分解 | 澄済石灰水变浑浊 |
| D | 石蜡油在碎瓷片上受热分解 | Br2的CCl4溶液褪色 |
| A. | 答案A | B. | 答案B | C. | 答案C | D. | 答案D |
 (或
(或
 ).
).